欢迎光临吉康旅!
2020年6月29日,美国FDA批准默克公司(MSD)研发的重磅炸弹PD-1抑制剂(简称K药)作为一线治疗不可切除或转移性微卫星不稳定性高(MSI-H)或错误匹配修复缺陷 (dMMR) 结直肠癌 (CRC) 患者。
这是该患者群体首次获批的一线免疫疗法,无需联合化疗。
此前获批用于非小细胞肺癌、小细胞肺癌、肝癌、肾癌、胃癌、宫颈癌、子宫内膜癌、食道癌、黑色素瘤、头颈部鳞状细胞癌、霍奇金淋巴瘤、尿路上皮癌、原发性纵隔癌大B细胞淋巴瘤、MSI-H实体瘤、默克细胞癌、TMB-H实体瘤、皮肤鳞状细胞癌。
临床数据
该批准基于一项多中心、随机、开放标签、主动对照研究 (-177),该研究评估了以前不可切除或转移性 MSI-H 或 dMMR 结直肠癌患者的疗效和安全性。
共有 307 名患者被随机分组(1:1) 接受 200 mg 每 3 周一次,n=153)或研究者选择的后续化疗(每 2 周一次,n=154):
(1)(奥沙利铂、亚叶酸和氟尿嘧啶)或与贝伐单抗或西妥昔单抗联合使用。
(2)(伊立替康、亚叶酸和氟尿嘧啶)或与贝伐单抗或西妥昔单抗联合使用。
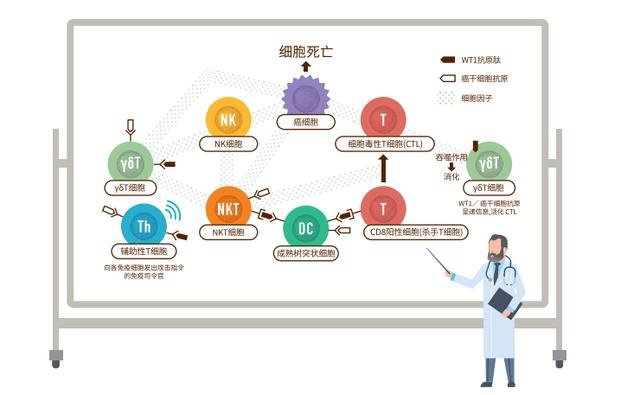
本研究的主要疗效观察指标为无进展生存期(PFS)和总生存期(OS),次要疗效观察指标为客观缓解率(ORR)和缓解持续时间(DoR)。
所有患者的人口特征为:中位年龄为 63 岁;47% 的患者年龄在 65 岁或以上;50% 的患者为男性;75% 的患者是白人,16% 是亚洲人;ECOG评分为0(52%)或1(48%);27% 的患者接受了早期辅助或新辅助化疗。
在随机接受化疗的 154 名患者中,143 名患者按照方案接受了化疗。143例患者中,56%接受方案,44%接受方案,70%接受贝伐单抗加OR方案,11%接受西妥昔单抗加OR方案。
在 PFS 分析时,总体生存数据不成熟(OS 最终分析所需事件数量的 66%)。中位随访时间为27.6个月(范围:0.2~48.3个月)。
研究数据显示,该组vs化疗组的中位PFS分别为16.5个月vs8.2个月;ORR 为 44% vs 33%,完全缓解 (CR) 为 11% vs 4%,部分缓解 (PR) 为 33% vs 29%;中位 DoR 为 NR(未达到)vs 10.6 个月,≥12 个月的缓解持续时间为 75% vs 37%,缓解持续时间≥24 个月的缓解持续时间为 43% vs 18%。
图注:MSI-H或dMMR结直肠癌治疗的临床数据

图例:MSI-H 或 dMMR 结直肠癌的治疗 PFS
不良反应
其他适应症见不良反应资料
警告和注意事项
免疫介导性肺炎
免疫介导的结肠炎
免疫介导的肝炎或肝毒性(与阿西替尼联合使用)
免疫介导的内分泌病
免疫介导的肾炎和肾功能不全
免疫介导的皮肤不良反应
其他免疫介导的不良反应
输液相关反应
异基因造血干细胞移植的并发症
在 K 药物中添加沙利度胺类似物和地塞米松会增加多发性骨髓瘤患者的死亡率
胚胎毒性
图例:已在全球上市的免疫制剂批准适应症汇总
【重要提示】本公众号【全球良药资讯】所有文章信息仅供参考,具体治疗请遵医嘱!
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话