欢迎光临吉康旅!
EGFR-TKI在治疗EGFR突变阳性的晚期非小细胞肺癌()方面取得了骄人的成绩,但无论是第一代、第二代还是第三代EGFR-TKI,最终都不可避免地会出现耐药性。随着对第三代EGFR-TKI耐药机制认识的逐渐深入,更多克服耐药性的解决方案进入了研究人员的研究领域。
识别耐药机制是探索耐药应对策略的基础
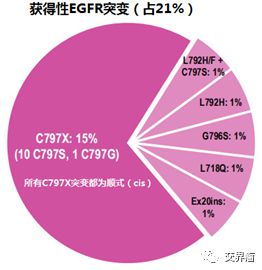
要克服第三代EGFR-TKI奥希替尼的耐药问题,首先要确定耐药机制。目前研究发现,常见的耐药类型有五种:一是EGFR下游信号通路的基因突变,如突变,占比约20%;二是EGFR扩增,目前临床上发现奥希替尼的患者比例有增加趋势;三是奥希替尼二线治疗后患者突变消失,约占40%;四是通路的激活,如c-Met扩增;第五,组织学改变,如转化为小细胞肺癌,比较少见。
EGFR-TKI联合抗血管生成治疗可延缓耐药,但需慎重考虑联合治疗的安全性和耐受性
过去,许多第一代EGFR-TKI研究联合抗血管生成药物贝伐单抗用于EGFR突变阳性晚期的一线治疗,我们称之为A+T方案。和研究),正如即将进行的中国 A+T 研究一样。此外,本次ASCO发布的西方国家EGFR-TKI联合抗血管生成新药雷莫芦单抗的研究也证明了该治疗模式的可行性。
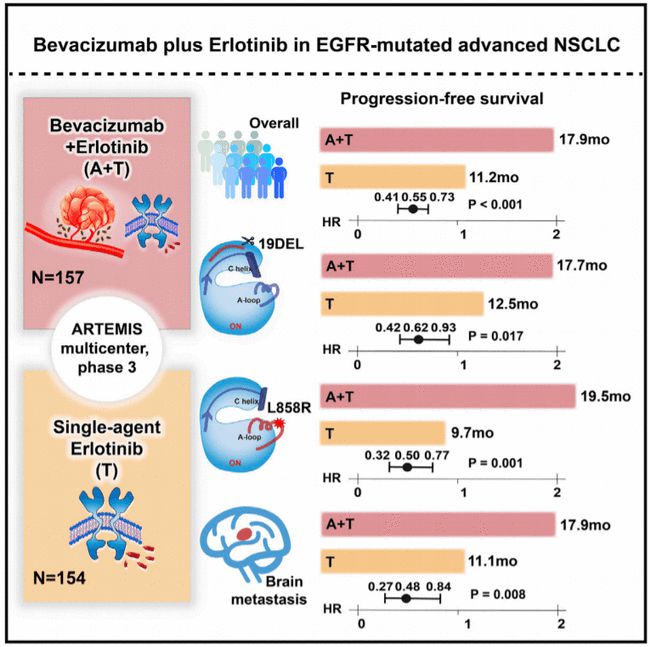
第三代EGFR-TKI单药治疗取得了巨大成功,但无论是第一代、第二代还是第三代EGFR-TKI,经过一定的治疗期都会出现耐药性。第一代EGFR-TKI药物产生耐药的平均时间约为10个月,第三代EGFR-TKI奥希替尼产生耐药的平均时间约为18个月。现在我们正在研究第三代EGFR-TKI联合抗血管生成治疗,进一步寻求延长无进展生存期(PFS),延缓耐药性的发生。以往第一代EGFR-TKI的研究经验让我们有理由相信,第三代EGFR-TKI联合抗血管生成疗法可以在单一药物的基础上进一步提高疗效。今年'
然而,我们应该注意在增加的生存获益和使用联合方案的患者所经历的毒性之间的权衡。随着患者接受更长的治疗时间,他们对生活质量和药物安全性的要求也会更高,这与患者在接受短期脉冲治疗时可以专注于较大毒副作用的情况完全不同。因此,对于单一药物治疗可以达到非常理想的PFS的药物(如奥希替尼),应进行任何与其他药物的联合治疗。公差被放在更高的位置来考虑。总而言之,在考虑联合治疗的应用时,应注意PFS的延长与患者的生活质量和耐受性之间的平衡。
未来研究方向:双特异性抗体为广泛克服EGFR-TKI耐药带来新希望
目前克服EGFR-TKI耐药主要有两个研究方向。一是基于耐药模型开发第四代EGFR-TKI,比如开发专门针对突变的TKI药物。变异在西方国家占20%左右,而我们东方国家的比例相对较低。遵循这种只针对某种突变开发新药的思路,会让这条路越来越窄。我认为覆盖面广、对其他罕见靶点有耐药性的药物,才是真正的第四代EGFR-TKI药物。然而,这对于小分子药物来说是非常难以实现的。另一个研究方向是双特异性抗体的开发。双特异性抗体可以广泛覆盖由多种机制产生的耐药性,例如 c-MET 扩增、
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话