欢迎光临吉康旅!
1:HER2阴性BRCA突变晚期乳腺癌,靶向化疗三联方案显着延长PFS
8月27日,发表了一项比较卡铂+紫杉醇±PARP抑制剂治疗HER2阴性BRCA突变晚期乳腺癌的疗效和安全性的研究。
这是一项国际多中心随机双盲安慰剂对照III期临床研究。2014年7月30日至2018年1月17日,入组年龄≥18岁,BRCA突变,来自36个国家和地区147家医院的组织样本。将513例经组织学或细胞学证实的二线化疗失败的HER2阴性晚期乳腺癌患者按照2:1的比例随机分为两组,分别给予卡铂+紫杉醇+或安慰剂直至病程变质或毒性无法忍受。该研究的主要终点是无进展生存期(PFS)。
结果显示,意向治疗组(337例)和安慰剂对照组(172例)的509例患者中,中位PFS为14.5个月(95%CI:12.@) >5-17.7) 和 12.6 个月 (95% CI: 10.6-14.4) . 进展或死亡风险降低 29% (HR: 0.71, 95%CI: 0.57-0.88, P=0.0016)
结论:在 BRCA 突变的晚期乳腺癌患者中,卡铂 + 紫杉醇显着延长 PFS 并降低进展或死亡的风险。
2 JAMA:纳武利尤单抗在口腔鳞癌患者新辅助治疗中的良好疗效
8月27日,一项评估PD-1抑制剂或PD-1抑制剂联合CTLA-4抑制剂作为口腔鳞状细胞癌患者新辅助治疗的安全性和有效性的临床研究发表在JAMA上。
从 2016 年到 2019 年,这项随机、开放标签的 II 期临床研究招募了 29 名未经治疗的口腔鳞状细胞癌患者。患者分别在第 1 周和第 3 周接受 3 mg/kg 纳武单抗或纳武单抗+(1 mg/kg,仅在第 1 周给药)治疗。患者在 2 个周期的治疗后 3 至 7 天接受手术。
14 名患者被分配到 组(N 组),15 名患者被分配到 + 组(N+I 组)。在基线时,有 20 名 T2 肿瘤患者、9 名晚期肿瘤患者和 17 名淋巴结阳性肿瘤患者。治疗后,21 名患者出现治疗相关毒性,N 组和 N+I 组分别有 2 名和 5 名患者出现 3-4 级不良事件。N 组和 N+I 组均有肿瘤反应的证据(体积反应:50%、53%;病理分期减少:54%、73%)。1 年 PFS 率为 85%,1 年总生存 (OS) 率为 89%。
研究人员说,在手术切除前用纳武单抗或纳武单抗+治疗是可行的,现有证据支持使用这些药物进行进一步的新辅助研究。
3 JAMA:AI算法可用于诊断乳腺X线报告
8 月 27 日,一项外部评估三种商业人工智能 (AI) 算法独立诊断乳房 X 光检查报告的研究发表在 JAMA 上。研究结果表明,商业 AI 算法可以评估具有足够诊断性能的筛查乳房 X 光检查报告。
本研究是一项回顾性病例对照研究,比较了 3 种商用 AI 检测软件独立分析乳腺 X 线图像的能力,并与放射科医师联合评估筛查效果。
该研究包括 2008 年至 2015 年接受乳腺癌筛查的女性,包括 8,805 名年龄在 40 至 74 岁之间的女性。所有研究对象都接受了乳房 X 光检查,没有乳房植入物或乳腺癌。研究样本包括 739 名被诊断患有乳腺癌(阳性)和 8066 名健康对照(乳腺癌阴性)的随机样本。筛查时或筛查后12个月内病理检查确定阳性随访结果,2年无癌随访确定阴性随访结果。三种类型的AI检测软件(AI-1、AI-2、AI-3))分析所有乳腺X线图像以获得癌症可疑分数。正常或异常的临界值定义为初读放射科医师的平均特异性 (96.6%)。
结果:病例组中,618人(84%)在乳腺癌筛查后确诊为乳腺癌,其中121人(16%)在筛查后12个月内确诊。
AI-1真假阳性率(也称为接受者、受试者、观察者操作特征)曲线面积(AUC)为0.956(95%CI:0.948-0.@ >965),AI-2算法AUC为0.922(95%CI:0.910-0.934),AI-3算法AUC 为 0.920(95%CI:0.909-0.931)。
基于放射科医师的诊断特异性,AI-1算法的诊断灵敏度为81.9%,AI-2为67.0%,AI-3为67. 4%;第一阅片医师的诊断敏感性为77.4%,第二阅片医师的敏感性为80.1%。AI-1联合初读放射科医师,诊断敏感性为88.6%,特异性为93.0%。
研究人员表示,商业化的人工智能计算机辅助算法可用于筛选具有足够诊断性能的乳房 X 光检查报告。但需要进行前瞻性临床试验来进一步评估人工智能算法的独立诊断性能。

4 JAMA:根据前列腺癌患者的风险水平调整主动监测的强度是可行的
根据 8 月 27 日发表在 JAMA 上的一项研究,根据个体风险水平调整主动监测的强度对于低风险前列腺癌患者是安全的。
主动监测目前是低风险前列腺癌患者的首要护理标准。但在主动监测的过程中,由于患者需要频繁到医院进行检查和综合评估,可能会增加患者的焦虑、并发症的风险以及重复检查带来的经济负担。
为了找到一种安全地减少低风险前列腺癌患者就诊次数的方法,研究人员开发了一种方法,包括阳性核心的百分比、诊断后活检的阴性历史、诊断时间、体重指数、前列腺大小、诊断时的前列腺特异性抗原水平,前列腺 使用包括特异性抗原动力学参数在内的 7 个因素的阴性预测模型来预测参与 PASS 研究的 850 名男性和参与 UCSF 研究的 533 名男性 4 年后发生疾病的风险。
结果发现,经过 4 年的随访,该模型对风险等级最低的 25% 患者的阴性预测值为 0.88,对于风险等级最低的患者,该模型的阴性预测值为 0.88。风险排名最低的 10% 的患者。阴性预测值达到0.95。
这一结果提示,在低危前列腺癌患者中,以上七种因素可以有效预测前列腺癌患者疾病进展的风险。对于低风险人群,降低主动监测的强度是安全的。
5之:奥希替尼在治疗突变方面毒性低于化疗,是治疗的首选
8月27日,该研究的最终生存分析结果在线发表。数据显示,与化疗相比,奥希替尼在既往使用第一代或第二代EGFR抑制剂进展后发生突变的晚期非小细胞肺癌()患者的生存结局上没有差异。相关,但奥希替尼组具有更好的安全性。
在 III 期研究中,279 名接受第一代或第二代 EGFR 酪氨酸激酶抑制剂(TKI)治疗的晚期和突变阳性晚期患者被纳入研究,随机分为奥希替尼(80 mg/天)组或化疗组。既往研究报道,奥希替尼组的中位 PFS 明显优于化疗组,分别为 10.1 个月 vs 4.4 个月(P<0.001),在数据公布后迅速成为治疗晚期一、二代EGFR-TKI及突变患者的国际金标准。
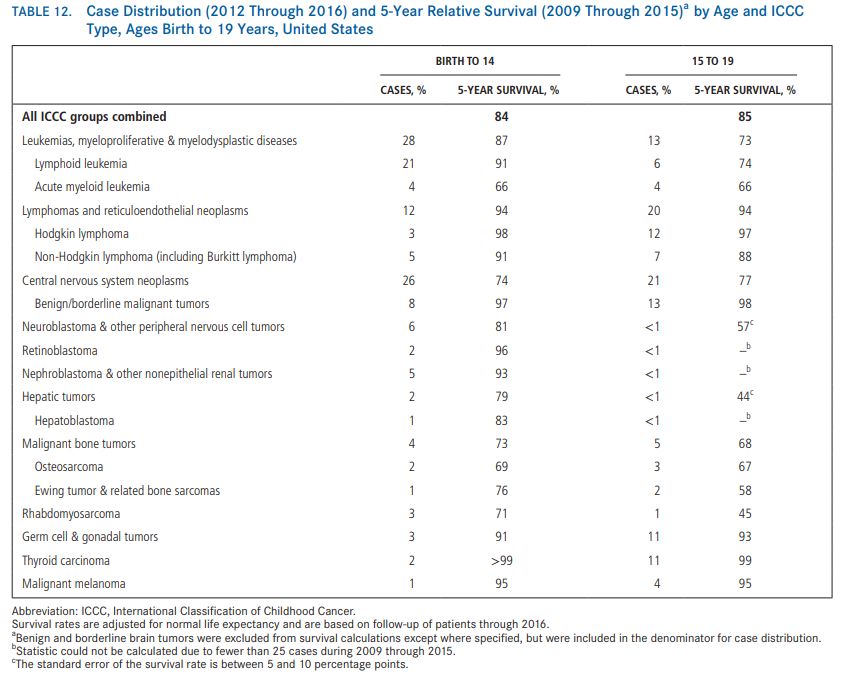
这次公布了生存结果。奥希替尼组和化疗组的中位OS分别为26.8 vs 22.5个月,未达到统计学意义(HR0.87,95%CI:0.@>67-1.12,P=0.277),估计 24 个月和 36 个月的 OS 率分别为 55% vs 43% 和 37% vs 30%。奥希替尼组在从开始到第一次序贯治疗或死亡的时间上表现出具有临床意义的优势,HR 为 0.21 (P0.21)。0.001)。
数据分析显示,化疗组有 73% 的患者转至奥希替尼组。奥希替尼组≥3级不良事件的发生率显着降低(9% vs 34%)。
参考
1. Vé Diéras, Hyo S Han, with and in BRCA- (): a , -, -, 3 。. 2020 年 8 月 2 日7. 的。
2. JD、GJ、Jo VY 等。或在口腔细胞中加号:A 2 Open-。贾马。27、2020.doi:10.1001/.2020.2955
3.,Erik,.JAMA 的 3 名成员。2020 年 8 月 2 日7. 的。
4. 先生、Y、AV 等。of 为 Low-Risk on 风险。贾马。27、2020.doi:10.1001/.2020.3187
5. 弗吉尼亚州。TS莫。J.-Y。韩,等。- 用于 EGFR 和 EGFR- : . : 27, 2020.DOI:: ///10.1016/j..2020.08.2100
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话