欢迎光临吉康旅!
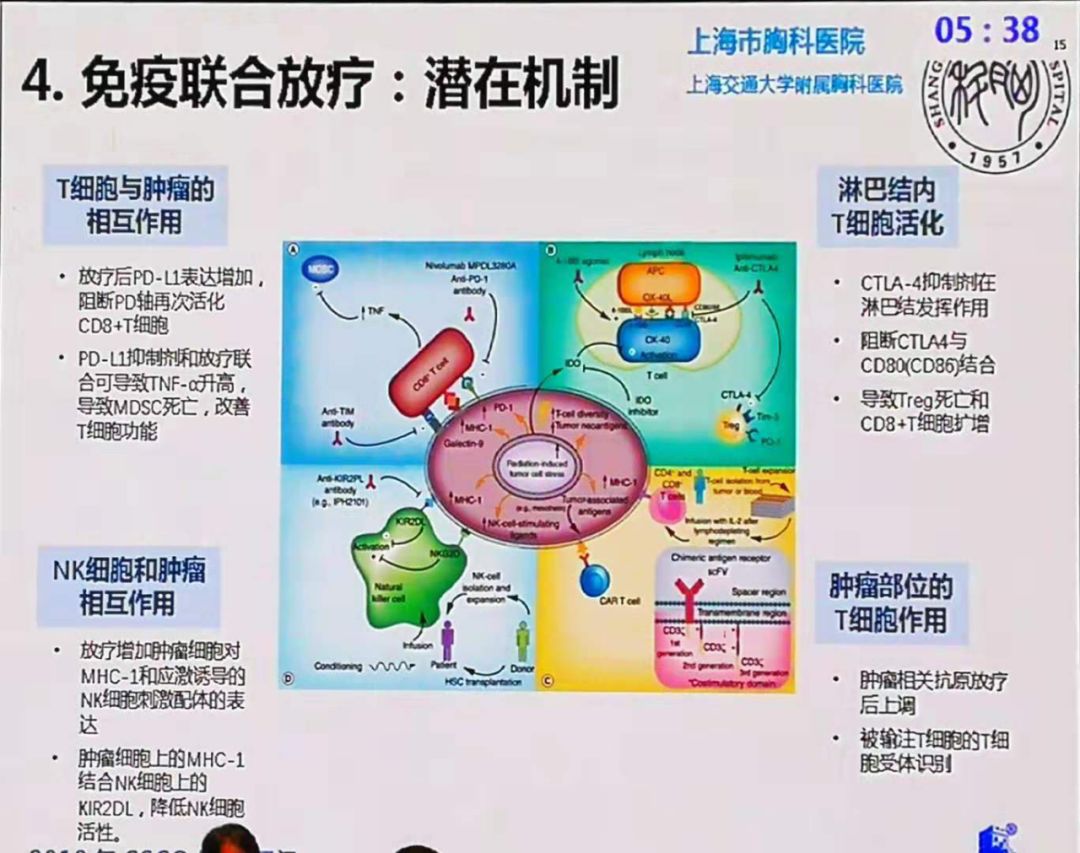
目前,晚期肝细胞癌(HCC)患者的一线治疗以靶向免疫联合为主,尤其是阿替珠单抗(泰生奇®)与安伐汀®(“A+T”)、优通®联合大博舒®(双达联合)已获国家食品药品监督管理局(NMPA)批准用于不可切除晚期HCC患者的一线治疗,证实了靶向免疫联合在HCC一线治疗中的优势地位!但在近期卡博替尼联合(“C+T”)一线治疗HCC的III期研究中,中期OS数据显示,虽然有改善趋势,但并未达到显着的统计学差异. 这是一个警钟!目标免疫虽然不错,并不是所有的目标免疫组合都能出道,有的只是“陪跑”而已。为什么与联合治疗肝癌的“C+T”和“A+T”差距如此之大?“C+T”在其他癌症中的作用是什么?
一、一阴一阳
肝癌预防一线路不通!
1
“C+T”一线治疗,PFS获益显着,OS有获益趋势!
-312研究是卡博替尼联合阿替珠单抗(“C+T”)一线治疗晚期肝细胞癌(HCC)患者的III期临床研究。主要研究终点包括无进展生存期(PFS)PFS和总生存期OS。最近,宣布 III 期研究达到了主要终点之一。与对照组索拉非尼相比,卡博替尼联合阿替珠单抗显着改善了PFS,导致疾病进展或死亡的显着风险降低了37%(HR=0.63;P=0.001< @2).不幸的是,中期分析结果显示,卡博替尼联合对OS有效,虽然有改善趋势,但尚未达到显着的统计学差异。预计将于明年初获得OS的最终分析结果。虽然距离最终OS结果公布还有一段时间,但在癌症治疗中,PFS获益但OS不获益乐伐替尼的临床研究并不少见,例如乐伐替尼一线治疗肝癌的研究。
2017年ASCO大会公布了10年来首次多中心、随机III期临床研究,在肝癌一线治疗中取得非劣效性。在不可切除的晚期肝癌患者中,乐伐替尼组的PFS明显优于索拉非尼组,两组的中位PFS分别为7.3个月和3.6个月(HR= 0.64,P但两组的中位OS达到非劣效性,即乐伐替尼组患者的中位OS为13.6个月, Ni组为12.3个月[风险比(HR)为0.92,95%CI为0.79-1.06]。对于肝癌患者来说,长期生活好是最终目标。
两组的 PFS 数据
两组OS数据
2
-312研究:PFS HR 0.63,OS失败概率高
对于肝癌研究,哪些PFS获益可以转化为OS显着获益,发表在2019年期刊上。对于II期和III期RCT研究,PFS的HR≤0.6。一篇转化为关于操作系统显着优势的结论的文章。
根据III期临床试验结果,在此前仅接受索拉非尼治疗的晚期HCC患者中,卡博替尼组的中位PFS为5.5个月,而安慰剂组为1.@ >9 个月(HR,0.40;95% CI,0.32-0.50),卡博替尼的中位 OS 为 11.3 个月,而安慰剂组为7.2个月(HR,0.70;95%CI,0.55-0.88),研究达到主要研究终点 OS,因此卡博替尼被 FDA 批准用于治疗已接受索拉非尼治疗的 HCC 患者。在本研究中,卡博替尼组的 PFS HR 0.40,确实带来了 OS 的好处到底。
此外,在2019年ESMO-ASIA会议上,150项研究结果显示,与索拉非尼相比,A+T可显着提高晚期不可切除HCC患者的OS和PFS,联合组和索拉非尼组的人数OS未达到和分别为13.2个月(HR=0.58,P=0.0006),中位PFS为6. 8个月和4.3个月(HR=0.59,P<0.0001),疾病进展和死亡风险降低41%,其中PFS HR= 0.59(≤0.6)的结果成功转化为OS显着差异,完美验证了这个结论!
在本次中期分析中,与对照组索拉非尼相比,卡博替尼联合阿替珠单抗组显着改善了PFS,并将疾病进展或死亡风险显着降低了37%(HR=0.63;P=0.@ >001<@2),所以虽然最终OS还没有公布结果,但很有可能是“陪跑”!
3
“A+T”一线治疗,PFS、OS明显提升!
回到“A+T”计划,基于全球人群和中国人群在III期研究中的OS数据结果,获得第一名,获得第一线靶点免疫称号国内外肝癌轨道项目,启动肝癌治疗。在全球501例患者中的新篇章,更新的OS数据显示“A+T”组和索拉非尼组的中位OS分别为19.2个月vs 13.4个月, 分别为 (HR=0.66; 95%CI: 0.52~0.85; P=0.0009), "A+T" 将死亡风险降低 34%!. 在中国人群队列中,“A+T”组与索拉非尼组的更新 OS 分别为 24.0 个月 vs 11.4 个月(HR= < @0.53; 95%CI:0.35~0.80),这也降低了47%的死亡风险!
全球人口操作系统更新数据
中国人口OS更新数据
4
为什么“C+T”复制不了“A+T”的辉煌?
与正常组织相比,肿瘤的血管形态和微环境有其特殊性。它们在肿瘤内常表现为扩张和回旋,扭动和转动,血管壁会出现缝隙,导致渗漏,血液也比正常血管好。介质更粘稠,流动时阻力更大,因此没有药物可以进入肿瘤。此外,它会产生酸性、缺氧的肿瘤存活状态。因此,使用贝伐珠单抗等抗血管生成药物一方面抑制肿瘤中复杂血管网络的形成,使其结构和血流更接近正常组织,同时改变典型的酸度和缺氧状态。免疫抑制环境减少了免疫抑制细胞的数量并恢复了部分免疫反应。T+A方案可以增加CD8+T细胞对肿瘤的浸润,同时将更多的新抗原暴露于癌细胞,显着提高了治疗效果。
正常组织(A)与肿瘤(B)血管系统对比
“A+T”是免疫联合抗血管生成抑制剂的代表,其次是大博舒®和大约托®的“双达联合”。而“C+T”其实就是免疫结合多靶点TKI药物的治疗方案。此外,还有派姆单抗联合乐伐替尼的“可乐组合”和®联合艾坦®的“双艾组合”。但与已获批用于一线治疗的一线免疫联合抗血管生成疗法相比,免疫联合多靶点TKI尚在研发中,尚未获批。
为什么会出现这种现象?例如,卡博替尼是一种涵盖九个主要靶点的广谱抗癌药物。主要分子靶点包括:MET、/2/3、ROS1、RET、AXL、NTRK、KIT等九大靶点。与其他类型的癌症相比,肝癌有其特殊的肿瘤微环境。与抗血管生成抑制剂相比,卡博替尼参与了抗癌过程,但不够集中。当然,这只是我个人的看法。仅供参考。
综上所述,是不是从一个方面说明了在肝癌的治疗中,免疫与抗血管生成抑制剂联用比免疫与多靶点抑制剂联用更值得推荐?从报告的研究结果来看,情况就是如此。当然,我们还需要等待双艾和可乐联合治疗肝癌一线治疗的III期临床结果的发布进一步讨论。
二、“C+T”泛癌物种布局:
免疫抵抗肺癌、前列腺癌和肾癌!
除了肝癌,“C+T”方案在免疫抵抗、前列腺癌、肾癌等癌症的治疗上也取得了不错的进展,尤其是卡博替尼和阿替珠单抗开展的-021研究。一项多中心 Ib 期研究评估了卡博替尼 + 在实体瘤中的疗效和安全性。
1
“C+T”治疗免疫疗法耐药,DCR高达83%!
2020年ASCO会议公布了之前接受过免疫治疗的患者(队列7).抑制剂ICI治疗中位时间4.8个月,中位随访时间8.9个月,根据1.1评价,确认ORR为23%( 11例),DCR 83%,反应时间1.4个月,反应中位持续时间5.6个月。最常见的治疗相关不良事件(TRAE)是腹泻(53 %)、疲劳 (37%)、恶心 (23%)、食欲下降 (20%)、手掌红斑感觉异常 (20%) 和呕吐 (20%)。
2
“C+T”治疗晚期肾癌,ORR高达58%:
2020年ESMO会议公布1b期-021试验结果:研究人员按照v1.1标准评价的ORR为40mg组53%(80%CI,41-65),在60mg组为58%(80%CI,46-70)。40mg组有1个完全缓解,60mg组有4个完全缓解;17各组部分缓解 40mg组14例 12例患者和60mg组病情稳定,此外,每组仅2例出现疾病进展。
3
“C+T”治疗晚期前列腺癌,DCR为80%:
根据1b-021期试验()的队列6数据,在过去接受过恩杂鲁胺和/或阿比特龙治疗的44名CRPC患者中,卡博替尼联合阿替珠单抗治疗的结果显示:ORR达到32%!DCR 为 80%。其中CR 2例[4.5%],PR 12例[27%];21 名 (48%) 患者患有 SD,中位治疗持续时间 6.3 个月。
参考
在 HCC 中:PFS 作为
免责声明:本文档所涉及的信息仅供参考,请遵循医生或其他医疗卫生专业人士的建议或指导。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话