欢迎光临吉康旅!
肺癌是世界上发病率和死亡率最高的恶性肿瘤之一。全球每年肺癌新发病例超过180万例,占所有恶性肿瘤的13%,每年因肺癌死亡近160万例,占所有恶性肿瘤的19.4%1恶性肿瘤死亡。我国肺癌的发病率和死亡率一直是所有肿瘤之首。据2014年公布的2010年我国肿瘤发病率和死亡率统计,肺癌发病率为46.08/10万,占所有恶性肿瘤的19.59%肿瘤;死亡率为37/100,000,占所有恶性肿瘤死亡的24.87%2。根据生物学特征,肺癌可分为小细胞肺癌和非小细胞肺癌。已经处于晚期,所以晚期的治疗一直是研究热点。现就2013年后期治疗的主要进展作一简要介绍,供同仁参考。
1 靶向治疗
随着肺癌驱动基因研究的逐步深入,肺癌的靶向治疗取得了很大进展。基于分子标志物筛选特定疾病人群并应用相应的靶向药物抑制肿瘤生长已成为肺癌治疗的新思路。肺癌突变协作组(LCMC)自2009年成立以来,主要分析肺腺癌的分子变异谱特征。美国有 14 个中心参加。这些中心具备检测10个驱动基因突变的条件,并根据患者的基因突变状态进行靶向。治疗并分配到临床药物试验3。在 2011 年美国临床肿瘤学年会上,Kris 首次报道了驱动基因检测的情况:共有 1007 名患者提供了肿瘤组织样本,其中 733 份样本获得了 10 项基因检测结果。超过60%的患者被发现有驱动基因,97%的驱动基因是互斥互斥的。 3. 2013年世界肺癌大会WCLC上,研究人员报告了该研究的组生存情况。接受靶向治疗的 279 名患者的中位生存期 (OS) 为 3.5 年; 313 名未接受针对发现的驱动基因靶向治疗的患者的中位 OS 仅为 2.@ >4 年;未鉴定出驱动基因的 361 名患者的中位 OS 为 2.@>1 年,组间差异显着(P=0.0001)4。本研究的结果有三个重点:第一,60%以上的发现有驱动基因的存在,第二,这些驱动基因基本是互斥的,更重要的是,发现驱动基因并接受靶向治疗的患者生存率明显提高。那些没有接受靶向治疗的人。
10% 的 EGFR 基因突变属于罕见突变(除外显子 19 和 21 敏感突变以外的突变)。台湾的杨先生在 2013 年的 WCLC 上报告说,阿法替尼在 II 期研究 LUX-Lung 2、 III 期研究 LUX-Lung 3 和 LUX-Lung 6 中用于治疗 EGFR 基因的罕见突变是前瞻性的学习。患者疗效 5. 3项研究共100例EGFR基因罕见突变患者,75例EGFR基因罕见突变患者接受阿法替尼治疗。罕见突变的疗效接近敏感突变,有效率71.1%,中位无进展生存期(PFS)和中位OS为10.7个月, 18.,分别为@>6个月;而初级突变和外显子20插入突变的有效率较低,分别只有14.3%和8.@>7%,中位PFS为2.@>9月和2. @>七月。
随着EGFR-TKI药物在EGFR突变患者中的应用,越来越多的获得性耐药患者成为新的挑战和研究热点。去年 WCLC 报告了 CO-1686 的首次人体评估,这是一种不可逆且高度选择性的 EGFR 突变(激活和)TKI6。在入组的 56 名 EGFR 突变患者中,70% 发生突变,45% 接受了至少两种 EGFR-TKI 药物治疗。研究结果表明,口服 CO-1686(900 mg,BID)治疗具有可评估耐药突变的患者,反应率为 67%。同样,在 I 期临床研究中,它已在 TKI 耐药患者中显示出良好的疗效7。 12例EGFR-TKI获得性耐药和突变患者中,7例达到客观缓解。
ROS1基因重排是一个晚期新分子靶点8,其临床特征是:年轻、不吸烟或轻度吸烟,大样本荧光原位杂交(FISH)筛查显示的ROS1重排比例1.@ >7%。在已完成的I期临床研究中,9,36名接受克唑替尼治疗的ROS1重排患者可评价疗效,有效率可达61%,6个月PFS率为76%。因此,克唑替尼被认为对肺癌新分子亚型ROS1基因重排患者除了ALK阳性外有效。
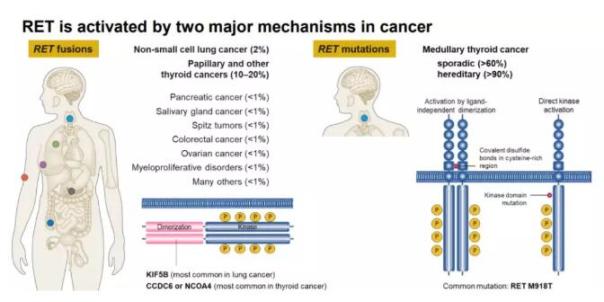
同样,关于 ALK 阳性、克唑替尼耐药药物的新药研究也有报道,包括来自和等人的研究数据。它是一种选择性的第二代 ALK 抑制剂。既往研究表明,在未经治疗的ALK阳性患者中,有效率高达93.5%。 2013 年,WCLC 报告了一项 I/II 期研究 10 的数据,该研究招募了 47 名患者,其中 87% 曾接受过治疗,21 名患有脑转移瘤,总体反应率为 54.5%。去年在 ASCO 上,来自马萨诸塞州总医院的 Shaw 报告了疗效11。它是一种选择性 ALK 抑制剂。在一项多中心 I 期临床试验中,131 名伴有 ALK 重排的恶性肿瘤患者入组。在可评价的88例肺癌患者中,有效率70%,显效64例。唑替尼耐药患者的有效率也高达73%,中位PFS8.@>6个月,说明它是克唑替尼耐药ALK阳性患者的有效二代药。
大约1.6% 的患者1.BRAF 突变呈阳性,尤其是在腺癌中。 BRAF 激酶抑制剂已被 FDA 批准用于用 BRAF 治疗晚期黑色素瘤。去年在 ASCO 会议上报告了对 12 项 II 期临床研究的中期分析结果。入组了 25 名在 IV 期一线化疗中进展的患者,并且 BRAF 突变呈阳性。最初入组的 20 名患者在治疗后的反应率为 40%。本研究首次证明BRAF抑制剂对BRAF突变体有效。
随着驱动基因研究的深入,越来越多的低概率驱动变异被发现。在我们看到进步的同时,我们也应该看到随之而来的问题。检测平台的适应性和新颖性临床研究的设计、靶向耐药性的未来研究、标本的重新采集,都是我们过去很少考虑但现在必须面对的问题。
2.@>化疗
虽然晚期的治疗方法多种多样,但在临床实践中,我们的医疗实践中仍然存在诊断后不立即治疗,采取“观望(WW)”模式的现象。 WCLC 去年报告的一项加拿大回顾性研究回答了 WW 模型是否可取 13。在诊断为晚期疾病的 694 名患者中,319 名(46%)接受了立即化疗,166 名(24%)接受了 WW,209 名(30%)接受了最佳支持治疗(BSC)。在 WW 组中,30% 接受了后续化疗,但 43% 错过了化疗。生存分析显示,即刻化疗组中位OS为14.2个月,WW组为11.8个月,BSC组为4.4个月(P
除了靶向药物和驱动基因的研究,化疗相关生物标志物的研究也在进行中。在 ASCO 去年报道的一项 III 期研究 14 中,患者被随机分为实验组和对照组,实验组将患者分为低/RRM1 低、高/RRM1 低、低/RRM1 高和高/RRM1根据表达水平,高4组分别给予多西他赛/卡铂、多西他赛/长春瑞滨、多西他赛/卡铂、多西他赛/长春瑞滨,对照组给予吉西他滨/卡铂。结果显示,各组的客观缓解率和总生存率无显着差异。尽管研究人员对结果做出了一些解释,但普遍认为该结果表明目前情况下RRM1不能作为化疗疗效的预测因子。
近年来,关于老年晚期疾病患者的治疗前评估一直存在争议。年龄和 PS 或综合评估系统 (CGA) 是否更能预测化疗?去年WCLC再次报道的一项III期随机对照临床研究探讨了老年患者CGA的评估:473名晚期老年患者纳入研究:年龄≥70岁,IV期,PS评分0-2 对照组根据年龄和PS评分确定治疗方案:年龄≤75岁、PS评分≤1的患者接受卡铂双药化疗(非鳞癌培美曲塞方案;鳞癌吉西他滨方案);年龄 > 75 年龄或 PS=2 分接受多西他赛单药化疗。课题组根据老年综合评估系统(CGA)的结果确定治疗方案; CGA评价分为好、中、差;好的患者接受了含卡铂的双药化疗(非鳞状细胞癌,培美曲塞;鳞状细胞癌,吉西他滨)。 ),中级患者接受多西他赛单药化疗,较差患者接受BSC;两组治疗结果显示,治疗失败时间(TTF)无显着差异(99天vs.98天,P=0.7149),无显着差异中位 OS(196 天 vs. 185 天,P=0.7784),然而,研究组的总体毒性发生率显着低于对照组(86.@ >2% vs. 93%, P=0.016). 虽然本研究中基于 CGA 的方案没有改善 TTF 和 OS,但研究组达到 26.0 @>5%的患者接受了BSC,虽然结果并没有表明CGA治疗明显优于传统方法,但避免了21.5%CGA差的患者过度治疗,降低了CGA的毒性。研究组。
相关的维持治疗是近年来的研究热点。 ASCO 报告了该研究的最终生存期,结果显示培美曲塞单药治疗与安慰剂相比可显着延长中位 OS 16,并且该研究还证明贝伐单抗维持可具有生存获益 17;而在 2013 年,该研究的结果,探索了培美曲塞和贝伐单抗的双重药物维持治疗,并在 ASCO 上进行了报道。既往未经治疗的IIIB-IV期非鳞癌患者接受4个周期的培美曲塞/贝伐单抗/顺铂治疗且无进展的患者随机分为两组,一组接受培美曲塞/贝伐单抗维持治疗,另一组接受贝伐单抗维持治疗;结果显示,双药组中位PFS为诱导治疗开始后10.2个月,单药组为6.6月,P=0.001 双药组中位OS为8月19.,单药组为9月15.,P=0.32。虽然生存率无统计学差异,但双药维持组生存期延长趋势明显。
基于以上化疗进展,明确晚期确诊应尽早给予适当治疗;分子标志物对化疗的预测作用有待进一步研究,但不足以指导化疗药物;建议老年患者使用 CGA。评估的治疗没有显示出生存优势,但避免了一些患者的过度治疗;与贝伐克/培美曲塞共同维持似乎优于单独贝伐克维持。
3.化疗和靶向治疗

化疗与靶向药物对比研究比中国胸科肿瘤研究协作组的0806研究更受关注。去年WCLC报告了0806研究的结果,这是一项比较培美曲塞和吉非替尼在EGFR野生型晚期非鳞状细胞癌患者二线治疗中的随机多中心临床研究。在 157 名可评估患者中,两组的主要终点 PFS 有显着差异,培美曲塞组分别为 4.8 个月和吉非替尼组分别为 1.6 个月。 HR=0.54, P
4.免疫疗法
通过阻断免疫抑制信号通路来调节肿瘤免疫微环境是近年来肿瘤免疫治疗的标志性成果之一。正常情况下,T细胞活化后可表达CTLA-4,与CD28分子竞争结合位于抗原呈递细胞(APCs)表面的B7分子,从而抑制B7与CD28的结合,从而影响细胞活化。 T 细胞并最终降低细胞毒性 T 细胞的肿瘤杀伤效力。 CTLA-4单克隆抗体可与CTLA-4结合,阻碍后者与其配体(CD80/CD86)的相互作用,增加T细胞的活化和增殖,使机体恢复免疫能力。攻击。非特异性免疫调节。II 期研究 20 显示晚期联合化疗对 OS 没有益处(9.7 与 8.@>3 个月;P=0.42.0@> ,但化疗序贯组的 PFS 有获益(5.68 与 4.63 个月;P=0.026)。目前处于 III-104 期本研究拟入组920例患者,旨在比较化疗或安慰剂联合化疗治疗IV期鳞状细胞癌的疗效。
活化的T细胞可表达程序性死亡因子-1(PD-1),其配体PD-L1可在多种肿瘤细胞中表达,包括肺腺癌和鳞状细胞癌)。高达45%~50%。两者的结合可以保护肿瘤细胞免受 T 淋巴细胞攻击,并且该途径是肿瘤特异性的。抗 PD-1 受体抗体 () 疗法于 2012 年在 ASCO 首次报道肺癌 I 期临床研究 21 评估的剂量范围为 0.1~10 mg/kg。在纳入的患者中,122 名患者可以进行安全性评估,76 名患者可以进行疗效评估。结果表明,该药物具有良好的安全性。 ,所有剂量组中只有 8% 的患者出现 3-4 级不良反应。在所有剂量水平均可见药物的临床活性,客观缓解率为18%,4个月PFS率为26%。 8mg的剂量用于治疗鳞状细胞癌和非鳞状细胞癌,有效率分别为50%和23%;在 10 mg 剂量下,鳞状细胞癌和非鳞状细胞癌的有效率分别为 43% 和 13%。目前正在进行两项III期临床研究,每组均入组一线治疗失败的鳞癌患者(264例)和非鳞癌患者(574例),对照组均为多西他赛。 2013年ASCO会议还报道了抗PD-L1抗体的早期试验(22,治疗晚期重症和晚期治疗的患者,有效率23%,PD-L1高表达患者的有效率均匀)更高,高达 83%。
综合以上数据可以看出,免疫治疗可能是继化疗和靶向治疗之后最具潜力的治疗方法。目前抑制剂研究的早期结果令人鼓舞,III期研究正在进行中。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话