欢迎光临吉康旅!
本研究是一项 Ib 期试验,旨在评估未接受全身治疗或全身治疗失败的中国局部晚期/转移性肝细胞癌患者的安全性、耐受性和抗肿瘤活性。分为两部分,第一部分是剂量递增研究,第二部分是剂量扩展研究。在剂量递增阶段,受试者将接受7.5 mg/kg(低剂量组)或15 mg/kg(高剂量组)贝伐单抗联合固定剂量®治疗,输入剂量完成剂量递增研究后的扩展阶段。该研究共招募了50名受试者,其中低剂量组29名受试者和高剂量组21名受试者。联合治疗方案的安全性与先前报道的临床研究结果一致,没有新的安全性信号。最常见的治疗相关不良事件 (TRAE) 包括高血压 (32%)、蛋白尿 (26%) 和发热 (26%)。低剂量组和高剂量组≥3级不良事件发生率分别为13.8%和28.6%。
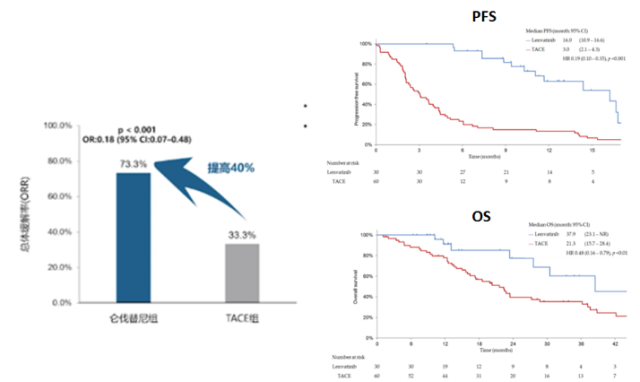
在疗效方面,总体客观缓解率 (ORR) 为 34%(17/50),低剂量组和高剂量组的 ORR 分别为 31% 和 38%。总体疾病控制率 (DCR) 为 78% (39/50)。中位无进展生存期 (PFS) 10.5 个月 (95% CI, 8.4-1 2.@) >7),中位总生存期 (OS) 20.2 个月 (95%CI, 16.1-24.3) . 进一步对 p=0.001) 和 OS 进行生物标志物分析(mOS:未达到 vs. 15.6 个月,p=0.023) . 肿瘤免疫微环境分析(TiME)表明,高密度的间质M1巨噬细胞(CD68+,-)与更好的疗效、更长的PFS和OS显着相关。
中国医学科学院肿瘤医院周爱平教授表示:“本研究不仅提供了信迪利单抗联合不同剂量贝伐单抗的安全性和有效性数据,而且发现了可预测的联合治疗肝细胞癌的方案。疗效的生物标志物可为临床指导用药中精准治疗人群的选择提供一定的依据。”
博士。信达生物制药集团高级副总裁周辉表示:“信迪利单抗联合贝伐单抗一线治疗晚期肝细胞癌于去年6月在中国获批,并成功纳入国民医保,本研究提供了联合用药的数据。使用两种不同剂量的贝伐单抗和信迪利单抗,同时探索肝癌免疫治疗疗效的预测因子,为临床医生提供更多更好的选择,推动肿瘤免疫治疗进一步向精准化和个体化迈进。”
博士。礼来中国高级副总裁、药物研发与医学事务中心负责人王礼来表示:“礼来与信达生物的合作致力于为中国癌症患者带来国际品质的抗肿瘤药物。 (信迪利单抗注射液)联合贝伐单抗治疗晚期肝细胞癌的Ib期研究数据为临床治疗的个体化、精准化治疗提供了更坚实的基础,旨在实现2030年癌症总体5年生存率的提高目标15%的增长将为加快推进‘健康中国2030’行动提供有力支撑。期待未来与信达生物继续深入合作,为更多患者带来福音。”
关于研究
这是一项 Ib 期研究,评估 ® 与贝伐单抗联合用于晚期肝细胞癌受试者的安全性、耐受性和抗肿瘤活性。该研究分为两部分,第一部分是剂量递增研究,第二部分是剂量扩展研究。在剂量递增阶段,受试者将接受7.5 mg/kg(低剂量组)或15 mg/kg(高剂量组)贝伐单抗联合固定剂量®治疗,完成后剂量递增研究,进入剂量扩展阶段。
关于肝癌
肝癌是世界上常见的消化系统恶性肿瘤。中国肝癌患者约占世界总数的一半。肝癌严重威胁着我国人民的生命和健康。肝癌的主要病理类型为肝细胞癌(HCC),占85%~90%;少数为肝内胆管癌(ICC)和HCC-ICC混合型。在我国,HCC主要由乙型肝炎病毒(B,HBV)和/或丙型肝炎病毒(C,HCV)感染引起。
推荐几个分享肿瘤诊疗指南、治疗PPT和肿瘤治疗行业最新资讯的公众号。欢迎大家关注。

电子医学
简介:分享肿瘤学领域前沿资讯、国际会议、国外指南等。点击:
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话