欢迎光临吉康旅!
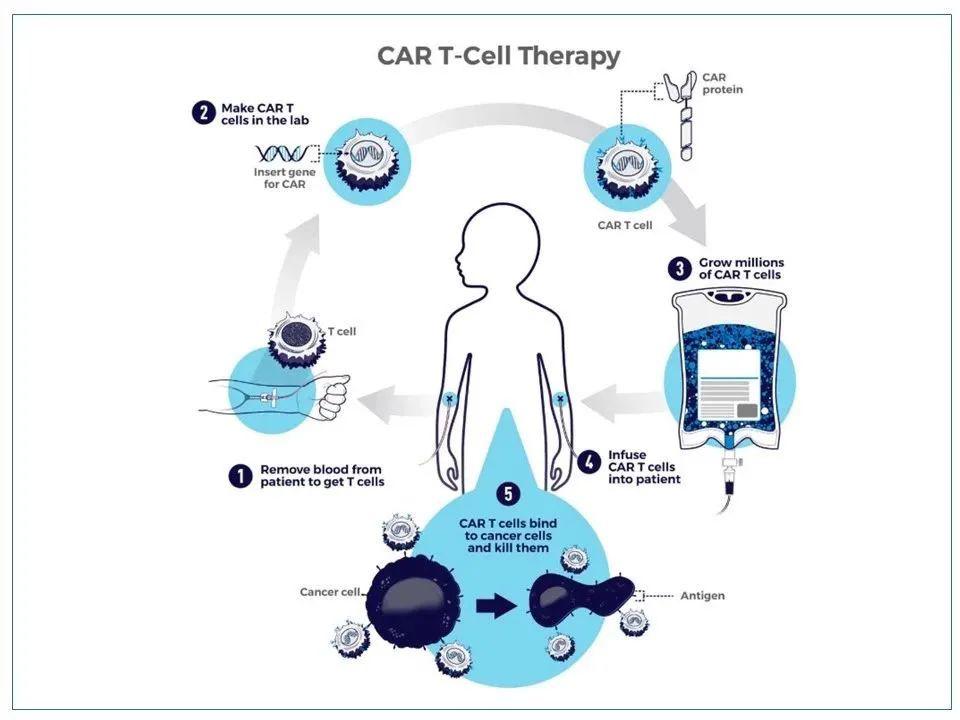
嵌合抗原受体T细胞(CAR-T)疗法的成功应用,开启了肿瘤免疫细胞治疗的新纪元。在血液系统恶性肿瘤领域取得了丰硕的成果,但对实体瘤的治疗效果却不尽如人意。 T 细胞受体工程 T 细胞 (TCR-T) 不仅可以识别位于细胞表面的肿瘤特异性抗原或肿瘤相关抗原,还可以识别细胞内的肿瘤特异性或肿瘤相关抗原,这使得它们可用于治疗实体。肿瘤更有优势。目前,TCR-T疗法已成为研究热点,是一种正在开发中的细胞治疗技术,有望治疗多种实体瘤。
什么是TCR-T疗法?
TCR(T细胞)是T细胞表面的特异性受体,与CD3非共价结合形成TCR-CD3复合物,通过识别和结合MHC呈递的抗原激活T细胞,促进T细胞分化与分化。
TCR-T 疗法需要对从患者身上获得的 T 细胞进行工程改造,使 T 细胞表达 TCR,从而有效识别肿瘤细胞并使其能够靶向特定的癌症抗原。这种新型疗法可以让医生为每位患者的肿瘤和不同类型的T细胞选择最合适的靶点进行工程改造,实现个体化治疗,为患者提供更大的缓解希望。
胰腺癌患者在 6 个月内缩小了 72%
胰腺癌起病隐匿,早期症状不典型,易误诊为其他疾病,极难治疗。它被称为“癌症之王”。近日,来自美国的Rom和Eric Tran等人在顶级医学期刊《新英格兰医学杂志》(NEJM)上发表了病例报告。研究人员对患者的自体 T 细胞进行基因工程改造,使其表达两种不同的 TCR,这些 TCR 对特定的 HLA 和瘤内突变的 KRAS 具有特异性,然后将 T 细胞输回患者体内。结果显示,患者有明显的肺转移。 6 个月时收缩率为 72%,在论文提交时患者仍在缓解。
患者信息和既往治疗
一位71岁的女性患者,67岁时被诊断为胰头腺癌,复发胰腺炎、胆道狭窄。 CA 19-9 和其他肿瘤标志物水平没有升高。
2018年患者因保留幽门的低分化腺癌(最大尺寸4.5 cm)行开放性切除术,切缘阴性,21个淋巴结中有2个切除受累淋巴结;治疗后疾病分期为ⅡB( )。随后患者接受了4个周期的辅助化疗,随后接受了50.4 Gy加卡培他滨的辅助放化疗。
2019年对患者右下叶肿大结节进行细针穿刺活检,诊断为肺转移。随后,患者出现无症状的双侧肺部疾病进展,无腹盆腔进展。
2020年,患者参加了匹兹堡大学医学中心的肿瘤浸润淋巴细胞治疗(TIL)临床试验,接受了体外扩增的肿瘤浸润淋巴细胞和大剂量白细胞介素2治疗,但在 6 个月时仍观察到肺转移瘤的生长。检测发现患者肿瘤中PD-L1的表达低于1%,肿瘤突变负荷8.9/Mb,微卫星稳定,存在KRAS G12D突变。此外,没有检测到基因拷贝数变异或基因融合。患者HLA基因型为HLA-C*08:02。
新的 TCR-T 疗法
2021 年 5 月,FDA 批准了一项单患者研究性新药申请。 2021年6月,患者接受了这种新型疗法。
胰腺癌肺转移患者重新输注了 16.2×109 个基因工程自体 T 细胞。这些 T 细胞被设计用于克隆和表达 2 个同种异体 TCR。其MHC基因型仅限于HLA-C* 08:02,具有KRAS G12D突变反应性,可靶向识别KRAS G12D突变肿瘤产生的新抗原。体外实验证实,工程改造的 T 细胞对 KRAS G12D 突变具有高度特异性,在体外用 KRAS G12D 突变多肽片段或 RNA 刺激时,可诱导 T 细胞分泌高水平的效应细胞因子,如 γ-干扰素和肿瘤坏死因子(TNF,图1)。
图1.野生型或突变型KRAS G12D多肽或RNA体外刺激T细胞分泌γ-干扰素和肿瘤坏死因子
功效
治疗后,患者肺部肿瘤明显缩小,达到客观缓解。治疗后1个月肺转移灶缩小62%,6个月时达到72%(图2)。T细胞在体内持续存在,1个月时占循环中所有T细胞的13%, 3 个月时 3.3%,6 个月时仍 2.4%。在过去的 3 个月中,患者外周血中的工程化 T 细胞在体外仍对 KRAS G12D 突变有反应,在KRAS G12D突变多肽片段的刺激下可产生γ-干扰素和TNF,表明它们的免疫作用持续存在。
p>
图2.治疗前和治疗后85天和176天的胸部CT结果
患者血清中效应T细胞细胞因子干扰素-γ、TNF、GM-CSF和CCL4浓度在基线时较低,但在细胞输注后一天显着升高并达到峰值(图3)当患者细胞输注11天后出院,与基线相比,干扰素-γ水平保持较高水平。细胞输注后约1个月,输注的T细胞约占循环中所有T细胞的10% 13%,3.3% 3 个月时,2.4% 在 6 个月时,主要是 CD8+ 细胞。
图3 血清细胞因子水平与T细胞存活时间
灵感
值得注意的是,在讨论中,研究人员提到另一名同样接受过TCR-T治疗的胰腺癌患者,在治疗前未进行托珠单抗预处理,导致患者输注后出现3级细胞因子释放综合征和 2 级神经毒性事件表明,治疗相关毒性仍然是 TCR-T 治疗的主要问题。另一方面,输注1个月后影像学检查结果显示,虽然肺转移灶略有减少,但肝脏病灶仍处于稳定状态,提示治疗的有效性和对靶器官肿瘤微环境的要求,等。仍需要进一步研究。
综上所述,本研究为胰腺癌KRAS G12D热点突变的TCR-T疗法开辟了新的思路,并在转移性胰腺癌患者的临床治疗中取得了良好疗效,为后续研究奠定了重要基础。 .
编者注
目前全球只有一种产品获批上市,因此于2022年1月25日获美国FDA批准用于治疗成人不可切除或转移性葡萄膜黑色素瘤。据悉,这是一种双特异性肽-HLA导向的CD3-T细胞接合剂,是全球首个上市的TCR-T细胞疗法。
TC-E202注射液是全球首个获批的靶向HPV的TCR-T产品,载有抗PD-1单链抗体。 TC-E202 编码 E6 TCR,同时编码抗 PD-1 单链抗体。链式抗体可变区片段。病毒感染后,T细胞可表达E6 TCR,同时分泌抗PD-1单链抗体。将TC-E202注入患者体内后,工程化T细胞表面表达的TCR可有效识别宫颈癌肿瘤抗原E6。被肿瘤抗原激活的T细胞被激活并可以杀死肿瘤。同时,修饰后的T细胞还可以分泌PD-1单链抗体,能有效消除对肿瘤微环境的抑制,增加T细胞浸润,增强TC-E202注射液对实体瘤的疗效。
TC-E202注射治疗阳性复发或转移性宫颈癌的I/II期临床研究已启动,患者招募已启动。
点击以下链接填写患者信息:
或添加小助手账号了解更多详情:
参考文献
T 细胞基因 .N Engl J Med 2022;386:2112-2119.
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话