欢迎光临吉康旅!
肿瘤,发病机制迥异,死亡率仅次于心血管疾病,已成为研发重点和市场主流。 2017年市场容量首次突破1000亿,是医药无法比拟的;整体年增长率为12%,远高于6%的平均水平,备受关注。
肿瘤市场的热点靶点无疑是其中的佼佼者,临床疗效和市场表现优异,深受患者和专业人士的青睐。
上期我们盘点了肿瘤市场十大热门靶向药物及治疗点(PD-1抑制剂、HER2抑制剂、CDK4/6抑制剂、BTK抑制剂、VEGF/抑制剂)将重点介绍(CAR-T疗法、EGFR抑制剂、ALK抑制剂、PARP抑制剂和ADC抗体偶联药物),了解它们的作用机制、临床疗效、市场趋势……
一、CAR-T疗法
CAR-T,全称T-cell,是嵌合抗原受体T细胞免疫疗法;其原理是在T细胞表面表达嵌合抗原 改变淋巴细胞特异性和功能的抗原受体。
肿瘤细胞可以降低抗原的表达,使T细胞不能以人白细胞抗原(HLA)依赖的方式被激活,从而使肿瘤实现免疫逃逸,发展为恶性肿瘤。 CAR-T疗法是利用生物技术表达能够特异性识别T细胞中肿瘤抗原的抗体,从而激活人体免疫系统杀死肿瘤细胞。 CAR-T疗法因其对血液肿瘤的极高反应率,甚至达到完全治愈,成为众多药企关注的焦点。
由于CAR-T疗法的高敏感性,与传统抗体药物相比,on-/off-毒性会导致更严重的副作用。因此,CAR-T疗法需要寻找更多的靶点。严格以肿瘤特异性抗原为靶点,如CD19、CD20、HER2、BCMA、EGFR等
从整体发展来看,第二代CARs结合了激活和共刺激信号,如CD28、4-1BB等,弥补了第一代共刺激信号的不足。 CAR-T细胞 然而,由于扩增无效、疗效不佳的问题,二代CAR是当今研发的主流。诺华和吉利德的 CAR-T 疗法均基于第二代 CAR。
与二代CARs相比,三代CARs多结合了一种共刺激信号,主要是为了弥补二代CARs不能兼具T细胞增殖和持久性的不足。第四代CAR在保留第三代共刺激和激活两种信号的基础上,进一步引入分泌细胞因子的基因,进一步增强对肿瘤的杀伤作用。
虽然CAR-T疗法目前在血液肿瘤中显示出显着的疗效优势,但在临床使用和市场拓展方面仍存在诸多问题。
1、CAR-T疗法由于过度激活免疫系统,很可能引起细胞因子风暴的严重副作用。
2、在实体瘤的治疗中,目前发现的新靶点仍存在不同的缺陷。
3、肿瘤细胞不仅会降低肿瘤抗原的表达,还会抑制肿瘤微环境中T细胞的活化,这也是实体瘤发展缓慢的原因。
4、目前CAR-T疗法使用自体细胞,导致制备过程困难,不同患者疗效差异,治疗费用高。
作为一种新兴的细胞疗法,CAR-T疗法的推出可谓一波三折,几近奄奄一息。不过,极高的响应率也吸引了众多医药行业的介入。如何扩大适应症、选择合适的靶点、成熟的技术、降低治疗成本,将成为未来CAR-T疗法需要解决的问题。
二、EGFR 抑制剂
EGFR是非小细胞肺癌()中最常见的突变驱动基因,约17%的患者会出现EGFR突变,中国等亚洲国家的突变概率高达30%。除了目前在药物中挥之不去的KRAS突变外,EGFR突变是目前最重要的驱动基因。
EGFR突变主要发生在18-21外显子,其中19外显子缺失突变和21外显子点突变是最常见的突变亚型,占所有突变类型的90%,第一代EGFR抑制剂(吉非替尼) 、厄洛替尼和埃克替尼)针对上述EGFR突变开发。
大多数患者在临床用药1-2年后会产生耐药性,这也是第一代抑制剂的最大缺陷。其中,抑制剂结合的氨基酸片段发生突变,导致出现耐药性,占50%。
二、根据第一代药物引起的突变而开发的第三代抑制剂,其设计思路和作用机制大相径庭。
二代开发的逻辑是,药物越有效,耐药性可能越晚出现。因此,第二代EGFR抑制剂利用共价结合不可逆地抑制EGFR。第二代药物虽然抑制效果更好,但并没有解决耐药性突变的问题。
第三代EGFR抑制剂奥希替尼不仅可以解决突变耐药突变的情况;还可靶向EGFR基因突变(包括18、19、21突变),发挥第一代抑制剂的作用;同时奥希替尼选择性较好,对野生型EGFR蛋白作用较弱,皮疹等副作用较少;最重要的是,它对脑转移也有效。
从市场表现来看,由于吉非替尼和盐酸厄洛替尼专利到期,竞争加剧,第一代EGFR抑制剂市场略显疲软。全球最畅销的盐酸厄洛替尼连年下滑,2018年跌幅达36%,销售额仅为5.49亿美元;目前国内最畅销的吉非替尼影响不大;贝达的埃克替尼经过多次调价,2018年略有回升,但随着国产仿制药的陆续上市,增长也难以为继。
2018年9月获批上市的达克替尼凭借其临床疗效优势(14.7 vs.9.2个月)无疑显着提高了PFS(无),也是首个显着改善OS的抑制剂(34.1 vs. 26.8个月),有望取代第一代抑制剂的一线治疗地位。
凭借多项大规模III期临床试验的优良数据,第三代抑制剂奥希替尼成为首选的一线药物。奥希替尼因其疗效优势、缺乏竞争对手、一线药物首选等优势,未来几年将保持高速增长。根据公司预测,奥希替尼有望在2024年进入肿瘤药物名单,入账近40亿美元。
三、ALK抑制剂
EML4-ALK基因融合是继EGFR基因突变后的又一重大致癌突变。白种人和华裔患者EML4-ALK基因融合阳性率分别为5%和3.3%-6.1%。
虽然ALK突变的频率低于EGFR突变,但ALK突变的耐药性和副作用较少,患者整体治疗效果较好。因此,ALK突变也被称为“钻石突变”。目前市场上有5种药物,包括第一代ALK抑制剂克唑替尼、3款第二代ALK抑制剂和最新上市的劳拉替尼。
克唑替尼是第一个口服 ALK 抑制剂,也是一种 c-Met 和 ROS1 抑制剂。可用于治疗ALK阳性和ROS1阳性的转移性非小细胞肺癌。
类似于 EGFR 抑制剂:
1、 ALK 抑制剂的总体疗效优于以前的标准疗法。
2、患者使用一年后通常会出现耐药突变,其中最主要的耐药机制是ALK的二次突变。
3、不易通过血脑屏障,对脑转移效果差。
第二代ALK抑制剂具有更好的活性,ALK蛋白在人体正常组织中的表达不如EGFR蛋白多,因此第二代ALK抑制剂的临床应用更为广泛。其中,具有代表性的抑制剂——盐酸艾乐替尼在疗效上全面碾压克唑替尼。中位PFS:艾乐替尼vs.一线标准克唑替尼(34.8 vs.10.9个月),盐酸艾乐替尼的出现,ALK突变的非小细胞肺癌真正成为可控的慢性病。罗氏一举超越辉瑞,成为 ALK+ 市场的霸主。
然而,辉瑞公司并没有坐以待毙。 2018年推出第三代ALK抑制剂劳拉替尼,可抑制9个对克唑替尼耐药的突变,几乎可以克服所有耐药突变。具有较强的血脑屏障穿透能力和强脑入脑作用,特别适用于对其他ALKs耐药的晚期患者。
未来几年,ALK市场将是辉瑞和罗氏的结合体,药效和市场增长空间不大。
四、PARP抑制剂
BRCA 和 PARP 是修复人体细胞 DNA 突变的两个最重要的基因。在死亡中,两者中的一个出现问题,细胞可以存活并变得更加依赖另一个。
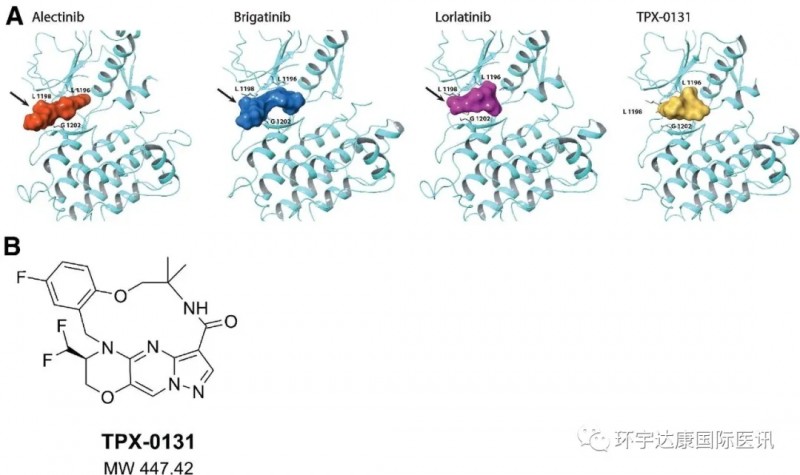
一方面,肿瘤细胞需要足够多的基因突变来积累生长优势,因此需要突变修复基因,比如BRCA。另一方面,肿瘤也需要DNA修复能力,否则会积累好的突变优势,很容易丧失,同时进入凋亡过程。
因此,具有 BRCA 突变的肿瘤细胞更加依赖 PARP,并且对 PARP 抑制剂更加敏感。 PARP抑制剂也因其临床优势成为近年来研究的热点领域,目前市场上有四种PARP抑制剂。
除了 BRCA 突变卵巢癌的初始适应症外,奥拉帕尼还捕获了 BRCA 突变的三阴性乳腺癌。上面我们提到三阴性乳腺癌发病率高,疗效差。问题是,就连PD-1抑制剂的多项III期试验也以失败告终。这种BRCA突变的HER2乳腺癌也迎来了PARP抑制剂市场的爆发。 2017年,免疫巨头默克以85亿美元收购了奥拉帕尼一半的股权。
五、ADC(抗体-药物偶联物)
抗体-药物偶联物(-drug,ADC)是一种具有生物活性的细胞毒药物,与特异性单克隆抗体相连,特异性单克隆抗体可作为载体,将细胞毒药物靶向并转运至靶细胞发挥作用的一类药物。
ADC同时结合了生物药和化疗药物的特点:具有细胞毒药物杀伤力强的特点,再加上特异性高的重组单克隆抗体,特异性高,不易产生耐药性半衰期长。
ADC结构由三部分组成:抗体、接头和小分子药物。抗体药物靶向HER2、EGFR、CD20、BCMA等,这些都是肿瘤细胞过表达的。化学药物通过连接区域和抗体耦合在一起。目前使用的化学药物主要有微管蛋白抑制剂、DNA小沟抑制剂(烯二炔类抗生素)等三大类。与化疗药物相比,前者对癌细胞的杀伤作用更强。
目前的ADC药物仍有几个限制因素需要克服:给药效率低、靶抗原在正常组织中的表达相同、靶抗原在肿瘤细胞中表达的异质性。
短短几十年,ADC药物的成功吸引了众多公司的青睐,每年报告的研究项目数量不断上升,基本涵盖了当今的主流靶点,如CAR-T疗法,这一新兴研究领域让我们充满期待。
结论:
肿瘤市场已取代心血管市场成为全球市场,热门靶点层出不穷,新疗法风起云涌,众多超级重磅产品诞生。 ,这些新兴药物也给了曾经的万病之王带来了治疗(治愈)的曙光。下一步,我们会将目光转向中国,看看这些热门靶材在国内市场和研发方面的进展。 (生物谷)
编辑推荐2019无锡国际生物医学论坛暨第九届细胞与国际研讨会——新药开发
? =
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话