欢迎光临吉康旅!
2021年《中国抗癌协会乳腺癌诊疗指南及规范(2021版)》(以下简称CACA-CBCS指南)于10月22日正式发布。癌症协会和复旦大学附属肿瘤医院。一经问世,便在学术界引起广泛关注和讨论。与2019版指南相比,更新后的指南包含了近两年在乳腺癌诊治方面的最新进展。值得一提的是,在HER2阳性乳腺癌的治疗中,指南新增了生物仿制药的定义,并指出曲妥珠单抗生物类似药可按照国内批准的说明书1的适应症使用,国际上紧跟指南。方针和规范,并结合中国实际。自2019年我国首个生物类似药获批以来,截至目前,我国已批准13个生物类似药,研发管线数量全球领先。虽然起步缓慢,但不影响生物类似药的研发。随着我国的快速发展,随着国内更多优质生物类似药产品的逐步推进以及相关评价原则和指南的逐步推进,生物类似药在我国已不再是新鲜事物的代名词,甚至在许多临床基层医院。,药剂专家也都耳熟能详。
事实上,从全球范围来看,NCCN指南(2019.V3)已将曲妥珠单抗生物仿制药列入2019年指南,指出曲妥珠单抗生物仿制药是对原研药的合理替代,包括曲妥珠单抗联合2. 同欧洲 ESO/ESMO 晚期乳腺癌国际共识指南(ABC 5)3 和其他国际指南 对曲妥珠单抗生物仿制药的推荐也包括在内。曲妥珠单抗生物仿制药的推荐我国CACA-CBCS指南与国外基本一致,对生物类似药的适应症为外推法和安全性,对临床应用问题进行了程序化指导和建议。
今天,我们请到复旦大学肿瘤医院余克达教授,结合CACA-CBCS指南对曲妥珠单抗生物类似药的临床应用进行权威解读。
于科达主任医师、教授、博士生导师
复旦大学肿瘤医院乳腺外科副执行主任
国家杰出青年基金获得者
中国抗癌协会乳腺癌专业委员会常务委员/秘书长
中华医学会肿瘤学分会乳腺组秘书长
中国抗癌协会肿瘤靶向治疗专业委员会委员
中国抗癌协会青年委员会主任
上海市抗癌协会青年委员会副主任委员
上海市抗癌协会乳腺癌专业委员会副主任委员/主任委员
上海市医学会肿瘤靶分子分会副主任委员
获明治生命科学奖;上海市银蛇奖、杰出学术带头人、杰出青年人才、苏光人才、金星人才;复旦大学校长奖、五四青年奖章、英才、才子学人;/ 作者在JAMA、J Clin、JNCI、Nat、Sci Adv、Res、Nat Rev等国际权威期刊发表学术论文。
生物类似药最受关注的问题:生物类似药与原研药疗效相同,安全性相似吗?
是的,引用的原研药和生物类似药在本质上是一样的。我能理解药学和临床专家的担忧或困惑,因为生物类似药在获批时的安全性数据和有效性数据不如原研药或其他获批新药广泛。生物仿制药在欧洲已经使用了十多年,在欧洲获批的生物仿制药比美国还多。据我所知,这些生物类似药均未因特殊或令人担忧的毒性而被撤回或警告。目前,随着单克隆抗体技术的进步,我们有60多种分析方法,将生物类似药与原研药进行比较,以证明两者是否具有高度相似性。此外,EMA和FDA对大分子单克隆抗体的放行审查仍然有非常严格的要求,因为这些单克隆抗体是更复杂的分子,其安全性和免疫原性更受关注。在我国,根据发布的《生物类似药开发与评价技术指南》,生物类似药是指在质量、安全性、有效性等方面与已批准注册的对照药相似的治疗性生物制品。获批上市的生物类似药经过了完整的相似性评价,确认与原研药无临床显着差异。在生物类似药的临床应用中,首要关注的仍然是其有效性和安全性。CACA-CBCS指南新增了生物类似药的定义,与指南的定义一致。同时,该指南明确指出“单抗药物曲妥珠单抗及其生物类似物、帕妥珠单抗、初始单克隆抗体的总体安全性良好1”,对实际临床应用和治疗具有重要意义。
生物类似药在严格的规定下被批准上市。为什么临床肿瘤学家对其适应症的推断存在疑问?
根据国家药品监督管理总局(CDE)5发布的《生物类似药相似性评价与适应症外推技术指南》5,“适应症外推”是指候选药物与参比药物的总体相似性。临床试验的直接比较证明候选药物至少在一个适应症上与参考药物临床相似,可以从与该适应症相关的研究数据和信息中推断出科学证据,支持其在中国作为参考药物使用. 其他尚未直接研究的适应症。
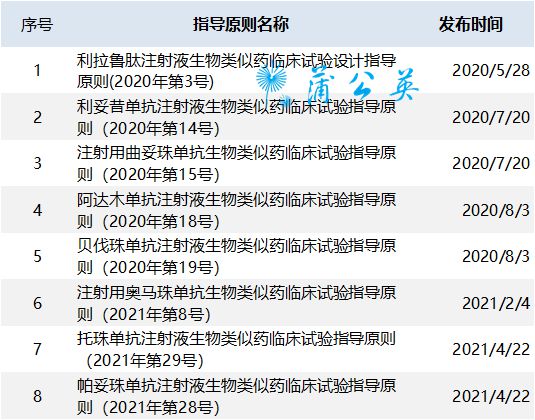
《指导原则》明确规定了三个适应症外推的基本条件5:1)使用了敏感的临床试验模型,可以检测参比药和候选药之间的差异;2) 临床相关 作用机制和/或相关受体相同;3) 生物仿制药的安全性和免疫原性已得到充分表征,推断的适应症没有特殊或额外的安全问题。
以曲妥珠单抗生物仿制药为例。已获批上市,并经过严谨、科学、完整的分析科学、临床前研究、临床药理学研究和临床研究,证明其功效与原药等效,安全性相似 6.同时, III期临床试验选择最敏感的临床试验模型-HER2阳性MBC一线治疗人群,观察到生物类似药与参比药高度相似,符合“曲妥珠单抗治疗” NMPA颁布的《类似药物临床试验指导原则》要求7。最后,曲妥珠单抗生物类似药与原研药具有相同的作用靶点,并且两者都是HER2受体。安全性和免疫原性已得到充分评估,外推的适应症没有特殊或额外的安全问题。因此,基于上述充分的科学研究,曲妥珠单抗生物仿制药已获批用于所有与原曲妥珠单抗相同的适应症。截至目前,国际上已批准12个曲妥珠单抗生物仿制药,均已成功外推至原曲妥珠单抗的所有适应症。
在今年最新发布的CACA-CBCS指南中,明确规定1“曲妥珠单抗生物类似药可按照国内批准说明书上的适应症使用”。可见,生物仿制药是经过严格监管审批后上市的,对其适应症的推断是科学安全的。
在现实世界的应用中,我们应该如何将生物仿制药的使用作为原始研究的合理替代品与其他方案相结合来合理对待?
在抗HER2治疗中,曲妥珠单抗联合帕妥珠单抗现已成为HER2阳性乳腺癌患者整个治疗的强制性课题。曲妥珠单抗和帕妥珠单抗都针对细胞表面的 HER2 蛋白。曲妥珠单抗靶向 HER2 蛋白胞外域的结构域 IV,而帕妥珠单抗靶向 HER2 蛋白胞外域。域II的结构,两种作用机制是互补的,具有协同作用8。曲妥珠单抗生物仿制药的靶点与原曲妥珠单抗相同。从本质上讲,曲妥珠单抗生物仿制药已经与原研药进行了头对头的比较和分析。其实,与原药的区别,就相当于不同批次的原药之间的区别。换句话说,曲妥珠单抗生物仿制药相当于不同批次的原研药。因此,曲妥珠单抗生物仿制药与帕妥珠单抗联合应用也可产生协同效应。
2019年NCCN指南2首次将曲妥珠单抗生物仿制药纳入指南推荐时,明确指出曲妥珠单抗生物仿制药是原药的合理替代品,并在HER2阳性乳腺癌的各种治疗方案中推荐使用曲妥珠单抗生物仿制药替代原曲妥珠单抗,包括与其他 HER2 靶向药物(帕妥珠单抗或 TKI)的联合治疗计划。在最新的 2021 年 NCCN 指南中,同样明确指出曲妥珠单抗生物仿制药是原始研究药物的合理替代品9。
在CACA-CBCS指南中,国内外常用的抗HER2治疗药物包括:曲妥珠单抗及其生物类似药等1,表明在基于曲妥珠单抗的抗HER2治疗方案中,曲妥珠单抗单克隆抗体生物类似药可以合理替代原来的曲妥珠单抗。
综上所述,生物相似性与原药一样,是一种利用生物技术制备的具有高度相似分子结构和生物活性功能的治疗性生物制品。经过完整的科学相似性评估后,批准上市。生物类似药的质量、安全性和有效性与原药临床无显着差异,可代替原药使用,包括与其他药物联合使用。此外,生物类似药被证明与原药相似后,可以共享原药积累的疗效和安全性数据,
近年来,生物类似药一直是我国研发的热点。其评价体系不同于新药。随着法规的全面完善,为生物类似药的研发创造了更好的环境。指南不断更新迭代,不断完善生物类似药评价体系。临床应用提供了更多的指导,临床医生在使用时会有更多的证据可以遵循。相信未来在法规和指南的指引下,生物类似药的应用将发挥更大的价值。正如指南所写,曲妥珠单抗生物仿制药“为中国乳腺癌患者提供了更多治疗选择1”,最终将使更多患者受益。

参考
1.《中国抗癌协会乳腺癌诊疗指南与标准(2021版)》
2.NCCN in (NCCN®).. 3. 2019.
3. F. 等。安。2018 年 8 月 1;29(8):1634-1657.
4. 食品药品监督管理总局。生物类似药开发与评价技术指南(试行)(2015).
5. CDE。生物类似药相似性评价与适应症外推技术指南(征求意见稿)(2020)
6. XU B, Q, SUN T, et al., and of with in with or HER2-: A III [J]., 2021.
7. CDE。注射用曲妥珠单抗生物类似药临床试验指南(2020)
8. 临床研究。2009年
9. NCCN in (NCCN®).. 2. 2021.
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话