欢迎光临吉康旅!
肺癌是我国发病率和死亡率最高的恶性肿瘤。如何规范肺癌诊治,造福患者,是临床医生必须面对的问题。本系列文章来源整理自北京协和医院肿瘤科王英义教授每周日晚播出的《肺癌规范诊疗系列讲座》。
编者注
大家期待音频后台播放功能吧!细绳!啦~
时间还没有赶上教授精彩的直播?
想一边看稿子一边听教授的原创讲解吗?
(点击播放器收听纯享受版的现场音频,同时学习知识~~)
王英义教授:罕见突变治疗辽——MET靶向治疗的曙光
|
00:00
00:00
王英义教授
北京协和医院肿瘤科教授
副主任医师、硕士生导师
北京市肿瘤病理精准诊断研究会青年精准诊疗分会副理事长、秘书长
CSCO青年专家委员会委员
北京市肿瘤防治学会免疫治疗不良事件管理委员会副主任委员
北京市肿瘤防治学会肺癌免疫治疗专业委员会常务委员
中国医学教育学会肺癌专业委员会委员
北京市医学奖励基金会常委、肺癌青年委员会委员
北京癌症研究会肺癌分会委员
中国医师协会结直肠肿瘤专业委员会青年委员会委员
中国医学促进会神经内分泌肿瘤分会青年委员会委员
北京市肿瘤质量控制中心化疗专业委员会委员
北京市肿瘤学会临床研究委员会常务委员
任职期间以第一作者发表SCI及核心期刊论文近30篇
诊断并成功治疗国内外首例小细胞肺癌扁桃体转移伴副肿瘤综合征
主持国家创新工程基金、中国医学科学院青年基金、CSCO专项基金和吴杰基金等基金数百万元
主要关注肺癌、罕见病发病机制及基因图谱建立、靶向免疫等精准医学探索
擅长肺癌/消化道肿瘤/乳腺癌精准诊疗,包括靶向治疗、免疫治疗等,擅长移动医疗管理和患者随访
MET基因异常在中国很少见,MET扩增是EGFR-TKI、ALK-TKI等耐药过程中最可能出现的现象。
本次演讲将来自
一、MET频道的发展历程和机制,
二、MET 突变的治疗策略,
三、MET扩增的治疗策略,
四、未来的MET靶向药物探索
分四个方面解释。
与EGFR相比,MET通路的发现会更晚,也就是1980年代。
MET具有与受体HGF(肝细胞生长因子)相对应的配体,其经历了受体发现、结构变化和临床试验。
2020年底,NCCN指南提出将MET作为独立诊疗途径,而此时也是MET抑制剂爆发的一年。
卡马替尼、特波替尼和国产的塞沃替尼都已经进入临床,进入了我们的视野。
MET基因是一种跨膜蛋白,分为细胞外、跨膜和细胞内三个区域。胞内结构域有一个酪氨酸激酶结构域,导致下游信号通路的激活,属于酪氨酸激酶受体。
MET通路的异常分为基因异常和受体异常,表现为跳跃突变、基因扩增、蛋白过表达和融合等多种形式。
基因异常是由染色体编码的基因结构的变化。最常见的是14号外显子的跳跃突变,由于近端膜区相应结构域的消失,“跳跃”导致MET蛋白降解破坏,不断激活下游信号通路,促进肿瘤细胞生长和增殖。
基因扩增也是一种基因异常。它是区域基因的重复。由于调控基因的增加,有一定的驱动潜力;但前提是单倍体。多倍体是染色体重复。有些人认为它的尺寸也更小。驱动潜力。
细胞外蛋白的过度表达是一种受体异常,可能与预后有关。MET融合是两个相距很远的基因,如基因a和基因b,由于中间的缺失而相互结合,因此基因a激活基因b,导致肿瘤细胞激活。
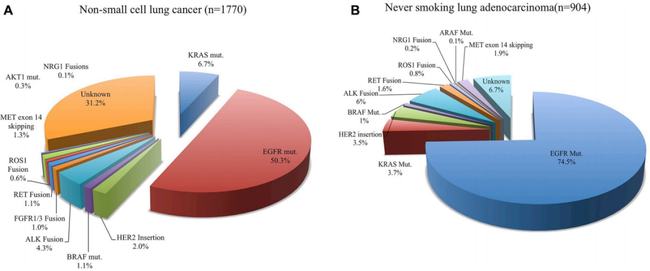
非小细胞肺癌跳跃突变的发生率为3-4%,肺肉瘤样癌的发生率为20-31.8%。非小细胞肺癌中MET蛋白过表达的发生率为25-75%。
新治疗患者MET扩增概率相对较低,治疗患者MET扩增概率不同:
第一代和第二代EGFR-TKI耐药患者中约有5-21%有MET扩增,第三代EGFR-TKI发生MET扩增的发生率更高,约为15-30%。
MET抑制剂因其结构不同分为Ia、Ib、II和III型。配体和受体相当于钥匙和锁,MET抑制剂是根据钥匙的结构来分类的。
I 型抑制剂的关键仅与 U 形结构中的 ATP 结合口袋结合。
II型抑制剂的钥匙有一个钩子,它不仅与ATP结合口袋结合,还与疏水口袋结合,可以更紧密地与靶点结合。
III型抑制剂的关键是延伸,延伸到由α螺旋位移形成的空腔中。
I型MET抑制剂分为传统药和新药。传统药物包括 Ia 类药物克唑替尼;新型药物包括Ib类药物卡马替尼、特波替尼和沃利替尼。
NCCN指南推荐将MET基因突变的治疗作为独立的诊疗路径,说明它也是一个被重视的独立基因,可以与EGFR、ALK齐头并进。
NCCN 指南建议应定期检查外显子跳跃突变;CSCO 指南建议应定期检查外显子跳跃突变和 MET 扩增。
MET扩增,尤其是高表达扩增,没有进入NCCN的独立诊疗路径,因为目前推荐的两种药物疗效不太明确,可能不比传统化疗好。
此外,联合治疗的副作用增加,不同检测方法的结果不同,也是不能作为独立诊疗路径的原因。
外显子跳跃突变是一个独立的致癌驱动基因。所谓致癌驱动基因,就是这种能够引起疾病转移的基因。控制好这个基因,有效率会很高,副作用会很低。
外显子跳跃突变是独立的致癌驱动基因,原因有两个:
首先,从直方图可以看出,外显子跳跃突变与其他驱动突变共存的概率非常低。KRAS同时突变概率仅为3.2%,EGFR同时突变概率仅为0.65%,未观察到与BRAF、ALK、ROS共存1、NTRK。
其次,它对传统的化疗药物或免疫药物效果不佳,这是驱动基因的一个特征。外显子跳跃突变一线化疗的中位OS为6.7个月,EGFR突变阴性无驱动基因一线化疗的中位OS为11.2个月。可见,对比驱动对于基因阴性的患者,化疗的效果并不好。
从上图可以看出,浅蓝色代表有效率,BRAF和KRS有效率在20%左右,ALK没有浅蓝色(代表缓解期的患者),有效率为0,EGFR只有12%,HER2 为 8%,MET 为 7%-8%。
作为独立驱动基因,BRAF和KRS阳性,免疫治疗效果更好。由于黑色素瘤BRAF基因突变概率较高,免疫治疗效果较好。
基因跳跃突变免疫治疗的效果很差,ORR只有17%,中位PFS只有1. 9个月。
自 MET 抑制剂问世以来,针对一线 MET 跳跃突变患者的免疫治疗几乎被禁止,因为其有效率太差。
是国产药,卡马替尼的实验设计比较复杂。所以,先说说国产药:
该研究的入组要求是接受治疗的患者或治疗失败的新治疗患者。包括的患者包括非小细胞肺癌和肺肉瘤样癌。
在药物剂量方面,根据体重要求,大于或等于50kg/天者使用,小于50kg/天者,主要终点为ORR,次要终点为PFS 和操作系统。
基线特征,肺肉瘤样癌患者比例为35.7%,脑转移患者比例为21%。
IRC 评估的 ORR 接近 50%,DOR 8. 3 个月。研究人员对情况的评估稍好一些。
亚组分析:
从病理分类上,肺肉瘤样癌和非小细胞肺癌的有效率在50%左右;
从治疗线数来看,初治和经济治疗的有效率分别为54.2%和46%。
因此,无论是病理类型还是治疗线数,赛沃替尼都表现出良好的肿瘤缓解率和疾病控制率。
安全性方面,外周水肿、胃肠道症状、转氨酶升高位居前三。
mono-1 研究是卡马替尼的经典研究。该研究设置了 7 个平行点。1a、1b 和2、3 个队列被纳入接受治疗的患者,不同之处在于 MET 基因的拷贝数。
拷贝数大于等于10为高表达,6-10为中表达,6以下为低表达,低表达小于4为超低表达;
队列 4 具有先前的 MET 突变,无论拷贝数如何。
队列 5a 是新治疗的患者,需要高基因拷贝表达且无 MET 突变。
无论拷贝数如何,队列 5b 都需要 MET 突变。
队列6是一个扩展队列,一部分是从1a拷贝过来的,一部分是从队列4拷贝过来的。
队列 7 也是一个扩展队列,它复制了队列 5b。
研究设计的主要终点是 ORR,次要终点是 PFS 和 OS。
基线特征,允许既往化疗治疗,但基本行数为1-3行。
新治疗MET突变患者有效率可达65%以上,治疗患者有效率在40-50%之间。
治疗患者的PFS仅为5-6个月,而新治疗患者的PFS为11-12个月,是治疗患者的两倍。
只有队列 5b 和队列 4 列出了 OS,初始治疗时间几乎是治疗时间的两倍,20.8 个月相比 13.6 个月。
该研究为研究,研究设计需要入组:
首先,过去的行数为0-2行,
二、排除脑转移患者,
第三,他过去没有接受过 MET 抑制剂治疗,允许之前的化疗。
第四,外显子跳跃突变。
药物剂量为 qd 口服,主要终点是 ORR。
基线特征,平均年龄为70岁,肺癌的平均发病年龄为55-62岁,研究的平均年龄为74岁,因此MET突变在老年人中更常见,ALK突变更多常见于年轻人,这是不同基因所特有的临床特征。
根据研究数据,ORR 为 46%,mPFS 为 8. 5 个月。
安全性方面,外周水肿、胃肠道反应、转氨酶升高、频发性贫血位居前四。
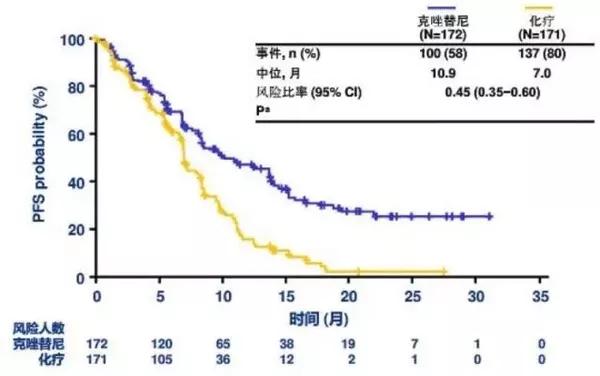
2016 年,1001 研究的扩展队列包括未接受 MET 抑制剂治疗而接受传统克唑替尼治疗的 MET 突变和非小细胞肺癌患者。
PFS 是 7. 3 个月,ORR 32%。可见克唑替尼也是一个不错的选择。毕竟,卡马替尼是自费的,而且更贵。价格在10万元左右一个月。
国内还有很多药物在临床研究中。JNJ-372 是一种明星药物。它是一种针对 EGFR 和 MET 的双靶点单克隆抗体。对20号外显子的稀有位点也有一定作用,正在研究中。有效率为25%。
综上所述,外显子跳跃突变是独立的致癌驱动基因,概率为1-3%,在肺肉瘤样癌中发生的概率可高达31.8%。
在各项研究中,MET抑制剂的有效率在40-50%之间,对控制脑转移患者的效果稍差一些。PFS 新治疗患者可达 10 个月,治疗患者可达 5 个月,新治疗患者可达 20 个月,治疗患者可达 13 个月。
单克隆抗体治疗主要针对细胞外末端,不是针对驱动基因的细胞内片段的抑制,所以效率稍差。对于独立的驱动基因,化疗和免疫治疗疗效较差。必须使用相应的靶向药物。现在指南也被改写,标准治疗时代已经进入。
MET扩增有多种检测方法,如二代测序、FISH和免疫组化。不同检测方法的结果并不完全一致。
二代测序检测拷贝数的增加,FISH通过荧光染色检测染色体数量,同时判断染色体是单倍体还是多倍体。免疫组化根据蛋白表达量判断基因扩增,但蛋白表达量和扩增量之间没有一一对应的关系。
三种检测方法的结果之间的关系如上图所示:
FISH 涵盖了所有下一代测序;
二代测序和 FISH 与免疫组化有重叠;
免疫组化检测蛋白过表达未见基因扩增或突变;
FISH与其他两种检测方法不重叠的部分是多倍体部分。
直方图的灰色部分代表多倍体染色体,其中一些对患者有效,有效率有待进一步确定。多倍体是否是肿瘤的驱动事件还需要进一步探讨。
MET的扩增分为一级条件和二级条件。
初级MET扩增的发生率很低,只有1-6%。
ERFR-TKI 耐药后,发生二次 MET 扩增。第一/二代EGFR-TKI耐药后MET扩增概率为5-15%,第三代EGFR-TKI耐药后继发MET扩增概率约为19-25%。
这是以往研究中不同条件下MET扩增比的饼图。
使用 MET 抑制剂单药治疗扩大 MET 的效果是有限的。mono-1 研究中的前三个队列都是具有不同 MET 扩增条件的接受治疗的患者。
队列 2 和 3 显示了 MET 扩增的低和超低表达。ORR 分别为 9% 和 7%。队列 1b 在 MET 扩增期间表达,ORR 为 12%。MET扩增中低表达的有效率非常高。低的。
高表达的治疗患者ORR可达30%,而新治疗患者的ORR可达40%。新治疗和治疗患者的OS只有10个月,PFS在4-5个月左右,已经相当不错了。
研究中,克唑替尼作为MET扩增队列中的单药,对高表达的要求进行了修改。MET/CEP7的比值大于等于4,表示高表达。低、中、高表达的ORR分别为33.3%、14%和40%。中低表达有效率相对较低。
MET 抑制剂作为单一药物治疗 MET 扩增的功效是有限的。组合的功效是什么?如何团结?
EGFR-TKI耐药后,MET扩增比例显着增加,从1~6%~20%甚至30%。因此,该研究使用奥希替尼联合萨沃替尼。B 和 D 部分包括过去的三代。药物治疗和过去没有经历过三代药物治疗的患者进一步细分为阳性和阴性患者。
该队列还探讨了 的剂量分层。根据 的体重依赖性,将不同口服剂量 qd 或 qd 与标准剂量组 qd 进行比较。
基线特征,以往的线数,后线的患者比例还是比较高的,三线到五线的患者比较多。
“初始治疗”实际上是指第三代EGFR-TKI的初始治疗。过去用过三代EGFR-TKI,ORR是30%,过去用过三代EGFR-TKI,不管他是阴性还是阳性,不管用什么药剂量 无论使用与否,ORR 都可以在 65% 左右。
新治疗患者的 PFS 也可以达到 9 个月。
经过三代EGFR-TKI治疗,患者的PFS只有5. 4个月,毕竟其有效率也受到了影响。
在安全性方面,由于联合治疗中3级以上AEs发生率高,50%的患者停药。虽然功效增加了,但毒性也增加了。
当患者出现MET扩增时,我们要告诉他们联合治疗是一种选择,但同时也要负责任地告诉他们,出现副作用的几率很大。
一旦出现副作用,我们会积极想办法处理。
该研究是最近刚刚报道的一项研究。是我国一项赛沃替尼联合奥希替尼的研究。案件数量并不多。一线奥希替尼单药治疗后,研究设计的入组要求也有所提高。在患者中,所有患者都必须有 MET 扩增。
ORR 为 41%。
在安全性方面,大于3级的不良反应为30%,可能是因为国内患者的耐受性相对较好。
让我们看看另一项联合研究——这项研究,使用卡马替尼联合吉非替尼。这是一项 Ib 期探索性研究,该列将在以后扩展以确定最大耐受剂量。II期研究主要是进一步观察有效性和安全性。
本研究中GCN大于等于6为高表达,高表达ORR达到47%。低表达的效率相对较低。
对于后来接受治疗的患者,联合治疗确实明显比单独使用MET抑制剂更有效。
中低表达PFS为4-5个月,高表达PFS可接近6个月。
联合治疗有两项研究,一项是研究,一项是研究。
该研究以吉非替尼qd联合的标准剂量为基础,入组需要EGFR-TKI耐药,免疫组化MET2+或MET3+,或GCN≥5的FISH。PFS是主要研究终点。
主要研究终点 PFS 是分层的。总体人群4.9个月,免疫组化高表达组PFS8.3个月,FISH检测MET扩增组PFS达到16.6个月。
就 ORR 而言,总体人口为 45%。高表达患者的ORR可达68%,扩增患者的ORR可达66%。因此,高表达、高扩增患者的ORR还是很高的。
MET扩增群体的OS可以达到37.3个月,是一个相当不错的结果,HR0.08相当低。
根据目前PR患者更新情况,最长OS可达58.5个月,但这些患者仍在用药过程中,仍在随访中。
通过免疫组化和二代测序检测的入组患者的PFS和ORR并不相同。是否存在多倍体的原因?多倍体是否会降低免疫组化高表达患者的疗效?多倍体是驱动基因吗?我们也不知道。
在不良反应方面,主要是水肿、转氨酶升高、脂肪酶升高。
该研究是联合奥希替尼,目前正在进行中。
这是EGFR-TKI耐药的MET扩增研究综述。PFS和ORR一目了然。和的PFS和ORR相似,卡马替尼的PFS和ORR稍差。
该研究旨在探索双靶点药物和靶向药物联合抗体的治疗,主要针对免疫组化高表达的患者,ORR从66%提高到87%。
在MET单克隆抗体联合厄洛替尼的研究中,ASCO初步公布了结果,入选标准为MET蛋白高表达的新治疗患者。
与单独使用厄洛替尼相比,联合治疗具有相似的PFS,且p值没有差异。
MET扩增高表达组差异明显。
对于单一药物,PFS 为 20.7 个月与 5.4 个月。随着表达的增加,ORR和PFS更高,OS还没有达到。
该研究纳入了同样接受过新治疗、MET 过表达 IHC3+ 或 IHC3+、萨沃替尼联合奥希替尼的患者,该研究正在进行中。
抗体偶联药物的一端与MET的抗体相连,另一端与相应的化疗药物相连,相当于一枚定位的巡航炸弹。它直接找到定位的位置并释放化疗药物进行轰击。
抗体偶联药物主要针对MET基因胞外段的抗体。在一些MET低表达的癌症中,它不仅具有直接杀伤作用,还具有旁观者作用。旁观者效应可以穿透细胞膜,达到没有药物的程度。对表达 MET 的细胞进行第二次杀伤。
研究的终点是ORR,分为两个步骤,第一阶段着眼于安全性,第二阶段进行扩展有效性研究。
MET的高表达ORR为18%,DoR为5. 9个月。
安全性方面尚可控制,主要不良反应包括腹泻、胃肠道症状、水肿等。
MET扩增发生在EGFR-TKI和ALK-TKI耐药后,EGFR-TKI和ALK-TKI联合MET抑制剂治疗。
目前一些联合疗法的研究正在进行中,我们希望未来能揭开相应的面纱。
总结
首先,MET是继EGFR和ALK之后的重要驱动基因,尤其是EGFR-TKI耐药的第一代、第二代和第三代。随着指南的推广和检测技术的提高,越来越多的药物将进入现实生活。
其次,单一的MET抑制剂对外显子14跳跃突变有很好的效果,在指南中已经获得了独立的诊断和治疗路径。
三是扩大MET,可以进行联合治疗,安全性可控,但仍牺牲部分安全性。期待后续的新药,包括双靶点药物、抗体偶联药物进行相应的研究。
视频指南:
【肺癌轶事】王英义教授:MET里的那点小事(第十讲)
小编提醒各位医生老师,如果大家在查看讲稿时有任何疑问,可以添加下方小助手二维码与王教授互动。
扫描二维码添加糖果,1v1与王教授互动
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话