欢迎光临吉康旅!
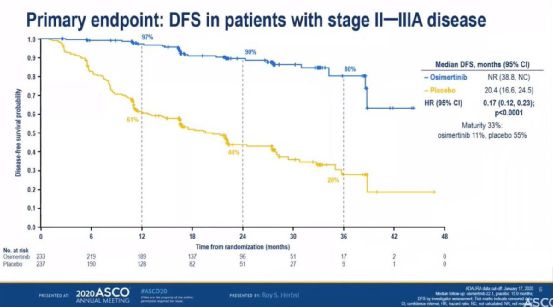
阿斯利康在9月8日的发布会上公布了奥希替尼III期研究的完整结果。 数据显示,奥希替尼一线治疗局部晚期或转移性EGFR+非小细胞肺癌的中位PFS为1< @8.9 个月,相比目前的标准疗法(厄洛替尼或吉非替尼)10.2 个月明显延长。
在所有亚组中,奥希替尼包括研究开始时有/无中枢神经系统 (CNS) 转移、亚洲/非亚洲、有/无吸烟史和缺席/外显子 19 的患者。疾病进展或死亡的风险降低至少 40%
研究关键临床数据
研究中,奥希替尼的安全性数据与之前临床试验中观察到的结果一致。3级以上严重不良事件(AE)发生率较低,包括皮肤干燥();对照组患者中最常见的 AE 包括腹泻 (3%) 和皮炎和痤疮 (5%)。
奥希替尼治疗组≥3级AEs发生率为33.7%,对照组AEs发生率为44.8%。此外,奥希替尼治疗组因AEs停药的患者比例为13.3%,对照组为1<@8.1%。
研究数据表明,奥希替尼有望成为EGFR+的新一线标准疗法。基于此,阿斯利康正在与全球卫生机构讨论奥希替尼一线治疗注册相关事宜。
阿斯利康全球药物研发部执行副总裁兼首席医学官肖恩表示:“数据令人振奋。到目前为止,即使第一代和第二代EGFR抑制剂带来了治疗进展,也只有不到20%的EGFR突变——阳性非小细胞肺癌患者可存活5年,数据显示,奥希替尼带来的早期和持续获益可能对患者的长期获益产生重大影响,有助于解决一直存在的问题。未满足的临床需求。”
奥希替尼于 2015 年 11 月 13 日以有效率数据(57% 和 61%)获得 FDA 批准用于 EGFR 突变患者的二线治疗。今年3月31日,奥希替尼获FDA全面批准用于该适应症(参见:奥希替尼获FDA全面批准:二线治疗可延长PFS5.7个月)。 2016年销售额为4. 23亿美元,销售额已达到4. 3亿美元。如果一线治疗获批,奥希替尼的销售额峰值有望达到30亿美元。
今年3月24日,奥希替尼也获得了CFDA的批准,正式在国内上市。距离美国FDA加速批准仅15个月左右(2015年11月13日)。可以说是创纪录 2007年实施化学药品注册分类后,我国进口药品上市速度创下历史(比9291快的可能只有2006年的索拉非尼,比2006年晚了8个月)美国市场)。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话
BottinibCabozantinib在脑转移肾细胞癌中表现出怎样的治疗效果?
2022-09-22奥拉帕利靶向药的适用卵巢癌类型,奥拉帕利用于卵巢癌化疗维持治疗的适应症
2022-09-22MET是一种由MET基因编码的受体酪氨酸激酶,许多癌症与MET受体途径的异常信号有关。METex14是一种公认的致癌驱动因素,在新诊断的晚期非小细胞...
在真实世界中,阿比特龙对转移性激素敏感性前列腺癌(mHSPC)患者中展现出了良好的疗效。以下是一例来自临床的经典案例:患者跳过化疗直接...
脑转移治疗的金标准是局部治疗,包括立体定向放射外科治疗、全脑放疗和外科手术治疗。脑转移RCC患者的体力状态较差,且通常需马上进行局...
奥拉帕利(利普卓)在卵巢癌共获批四大适应症,维持和挽救两种用法:①单药用于BRCA1/2胚系和体系突变,一线含铂化疗后达到CR/PR晚期卵巢...
4项不同研究分析数据证实,Vitrakvi(拉罗替尼)对携带NTRK融合基因的实体瘤(也称为TRK融合肿瘤)患者有持续临床获益。结果已在2021年9...








