欢迎光临吉康旅!
非小细胞肺癌的诊治发展可谓日新月异。继今年6月发布了NCCN 2020.V5版非小细胞肺癌指南。近日,V6版指南再次更新了非小细胞肺癌的诊断和治疗。这次更新还有很多重点。双免获得一线推荐。小靶点方面,还有两个更高级的靶点,RET/MET,已经成为初期治疗的必查靶点。此外,还有很多更新。不要等我,让我们一起享受最新版本!
定位文章
一、RET和MET属于后期一线常规检测推荐,六大靶点令人印象深刻!
2020年,小靶点的快速进展和疗效相当的药物的出现,促成了肺癌小靶点领域的兴起。而这份 NCCN 指南正是为此而生的。在晚期未经治疗的非小细胞肺癌患者的治疗中,建议对于非鳞状非小细胞肺癌,在之前需要的四个基因中增加了MET基因14突变和RET基因的检测EGFR/ALK/ROS1/BRAF。融合检测。已形成六项晚期非鳞状细胞癌必查基因检测。目标团队进一步扩大!对于检测呈阳性的患者,首选靶向治疗!
1.突变处理
对于 MET 外显子 14 跳跃突变的晚期肺癌患者,指南推荐卡马替尼作为一线治疗,部分病例可选用克唑替尼。(目前国内的MET药物还比较有限。卡马替尼只在国外获批。克唑替尼虽然是国内上市的药物,但只有跨MET靶点,疗效有限。目前我还是很看好来自和记黄埔,国产药物沃利替尼上市,药效数据不输进口,已获得国内NMPA的优先批准,有望迅速成为国产龙头药。 )
药品数据展示:
今年,MET领域取得了很大进展。已获FDA批准上市,已获批在日本上市,国产已获中国NMPA优先考虑。三大药的疗效基本相同,总结如下。值得一提的是,在下表中,MET抑制剂除了突变之外,在MET扩增方面也取得了一些成绩。同时,基于MET靶点在EGFR/ALK耐药中占有重要地位和比重,EGFR抑制剂+MET抑制剂的联合研究也频频取得积极成果。未来,因MET在肺癌中的应用而受益的人数将不断增加!
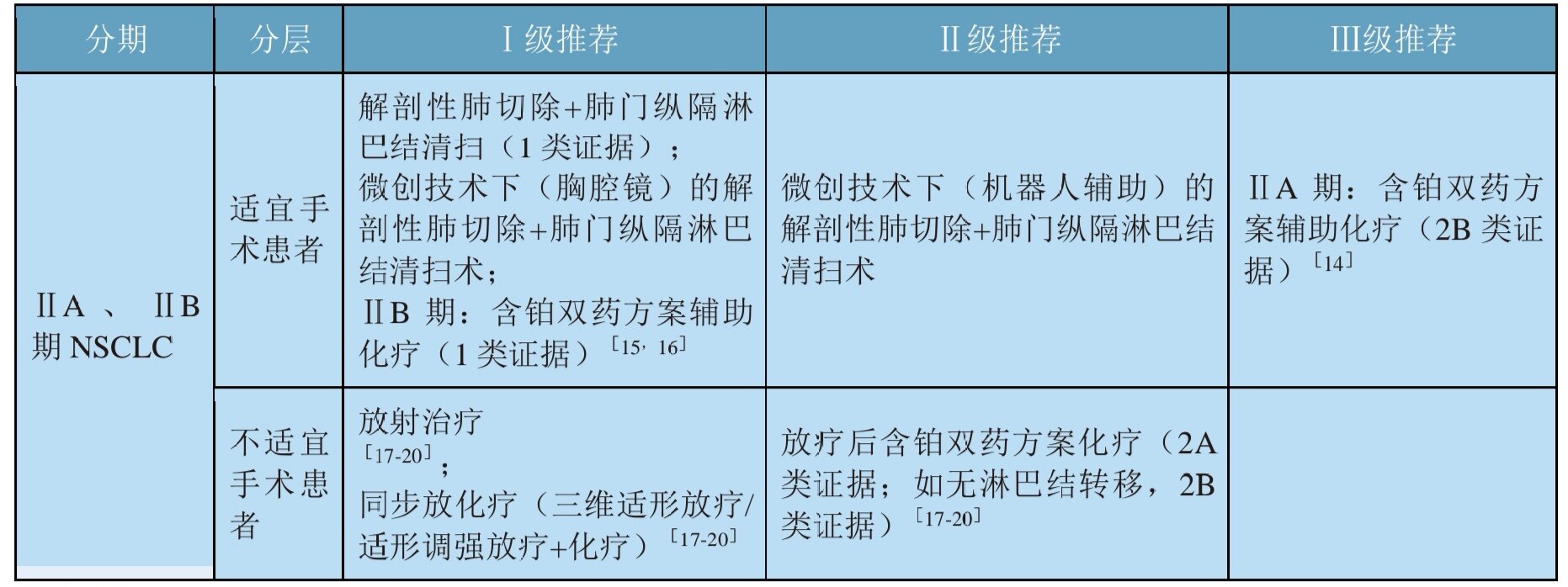
2.RET融合疗法
对于 RET 融合的晚期肺癌患者,本指南推荐一线使用(LOXO-292),在某些情况下推荐卡博替尼( )、凡德替尼或( )。
药品数据展示:
基于85%的绝对高效率,LOXO-292已成为全球首个获批的RET基因靶向药物。卡博替尼和凡德他尼都有RET靶点,也有一定的临床疗效。同时,ASCO还公布了今年另一款BLU-667的RET数据结果,疗效也相当可观。RET的一些新药大量问世,后劲十足!
二、EGFR-TKI 联合 NCCN 指南推荐的抗血管通路
EGFR单药研发进入瓶颈期后,EGFR联合治疗全面开花,高效数据频频曝光。基于今年FDA的批准和结果的公布,两种靶向联合抗血管方案(厄洛替尼联合雷莫芦单抗、厄洛替尼联合贝伐单抗)正式写入指南,成为EGFR阳性患者的一线选择. (目前国内学者也在普及EGFR精细化治疗的概念,一致认为TKI单药治疗突变患者疗效不佳,一线可采用这种联合方案。不过,目前没有关于总体生存率的比较数据,
药品数据展示:
(1)2020年6月1日,礼来公司宣布FDA批准雷莫芦单抗联合厄洛替尼用于外显子缺失或外显子21突变的转移性非小细胞肺癌一线治疗。在一项 III 期研究中,研究表明,与安慰剂 + 厄洛替尼相比,雷莫芦单抗 + 厄洛替尼显着提高了患者的无进展生存期,PFS 分别为 19.4 和 12.4 个月,将疾病进展和死亡的风险降低了 41%,具有明显的统计学差异(HR=0.59;95% CI,0.46,0.76;p
(2)厄洛替尼联合贝伐单抗的疗效已在研究中得到证实。这是一项在日本进行的随机、开放标签、多中心的III期临床试验。入组患者按1:1随机分配两组均接受厄洛替尼加贝伐单抗或厄洛替尼(每日一次),结果显示联合组中位PFS为16.9个月,厄洛替尼单药组为13.3个月, p=0.016,达到研究的主要终点。
并且无论EGFR突变亚型如何,厄洛替尼+贝伐单抗均显示出PFS优势,但遗憾的是并未将PFS优势转化为OS优势。
上述两项研究表明,TKI+抗血管生成治疗的联合治疗可以延缓一代TKI的耐药时间,显示出靶向联合抗血管生成的广阔前景。
三、对奥希替尼耐药管理和脑膜转移治疗的推荐
1.随着越来越多的基因分析表明,TKI耐药后,2%-15%的患者会发生小细胞肺癌型转化,这些患者应立即加入小细胞肺癌的治疗。达到临床缓解。因此,本指南建议对奥希替尼耐药后发生多灶转移的患者应考虑再次活检以排除SCLC转化。(临床上也可以结合肿瘤指数NSE和检测报告RB1/TP53辅助预测)

2.对于 EGFR 进行性脑膜转移的患者,无论有无突变,奥希替尼是唯一推荐的 160 mg 剂量。
药品数据展示:
是一项 I 期前瞻性研究,评估第三代 EGFR 抑制剂奥希替尼()在已经接受 EGFR 抑制剂治疗的 LM 患者中的疗效和安全性。该研究招募了 41 名经细胞学证实的 LM 患者,他们每天接受 160 mg 奥希替尼治疗。结果显示,84%的患者(31名可评估人中的26名)脑外肿瘤病灶不同程度缩小!平均收缩率为36%!另外 28% 的患者(40 名中的 11 名)在治疗后脑脊液中没有确认肿瘤细胞。总体而言,研究者评估的 ORR 为 41%(95% CI,26%-58%),中位 DoR 为 8.3 个月(95% CI,5.6-16. 5个月)。研究者评估的中位 PFS 为 8.6 个月(95% CI,5.4-13. 7 个月),成熟度(疾病进展或死亡的比例)78 %;中位 OS 为 11.0 个月(95% CI,8.0-18.0 个月),成熟率为 68%。
奥希替尼对脑膜转移的EGFR突变非小细胞肺癌患者中枢神经系统功能改善表现出良好的治疗效果,每天的安全性可控。
四、突变加威罗非尼或达拉非尼单药治疗
在本指南中,对于BRAF突变患者的一线治疗,除了达拉非尼联合曲美替尼的一线优先方案外,还增加了威罗非尼或达拉非尼单药的“其他推荐方案”。
药品数据展示:
BRAF今年成绩斐然,肺癌只是小费。作为多种癌种共有的驱动基因,其今年最耀眼的数据来自于一线黑色素瘤阿特珠单抗联合维罗非尼联合科比替尼,有效延长PFS(15.1月:10.6个月),在获得FDA快速批准后,BRAF进入了靶向免疫联合的第三阶段,希望这样的方案能够在肺癌领域重复高效数据。
免疫
一、O+Y双免疫两大方案正式进入晚期肺癌一线选择,涵盖鳞癌和非鳞癌,无论PDL1阴性还是阳性!
今年,双免计划取得了两个双阳性结果。通过研究和研究,提出了O+Y双免疫和O+Y+2周期短化疗两大方案,并迅速获得FDA批准。正式将晚期驱动基因阴性非小细胞肺癌带入无化疗模式。PDL1阴性和阳性患者组均获得了阳性结果!完全覆盖!
药品数据展示:
(1)-227 研究是一项多中心、开放标签、随机 III 期试验,比较铂类双药化疗与或 + 在未经治疗的 EGFR/ALK 突变阴性晚期或复发患者中的疗效。今年,ASCO 宣布了为期 3 年的227研究的OS随访结果:在PD-L1≥1%的患者组中,1/3的患者活了3年以上,与传统化疗相比,死亡风险降低了21%;PD-L1 < 1% 患者 与化疗相比,PD-L1 <1% 的患者从双重免疫治疗中获得更大的 OS 获益,HR 0.64 (95% CI, 0.51~0. 8< @1),3年OS率分别为34%(NIVO+IPI)、20%(NIVO+化疗)和15%(化疗),翻倍!降低了36%的死亡风险。
-9LA 研究是一项多中心、开放标签、随机 III 期试验,比较铂类双药化疗与 NIVO + IPI + 2 周期化疗在未经治疗的 EGFR/ALK 突变阴性晚期或复发患者中的安全性。结果显示,与单纯化疗相比,O+Y+2周期化疗组可显着延长患者的OS(HR=0.69, 96.71% CI:0. 55~0.87,P=0.0006),死亡风险降低 31%。中位 OS 为 15.6 vs 10.9 个月( HR=0.66, 95%CI: 0.55~0.80)。1年OS率分别为63%和47%。亚组分析显示即,无论患者的 PD-L1 表达水平和肿瘤组织学类型(鳞状或非鳞状)如何,疗效评价显示临床获益。增加2个周期的短化疗也解决了免疫反应起效慢和化学免疫早期的问题。弯道交叉的尴尬问题。临床实用性强。
二、 纳入 PD L1>50%(鳞状和非鳞状)一线优先推荐方案
在V6版指南中,在PD L1>50%(鳞状和非鳞状)的一线优先推荐方案中增加了,打破了PD L1>50%晚期K药的垄断。
药品数据展示:
110 是一项 III 期、开放标签、随机、对照、全球多中心临床试验,在 572 名 PD-L1 筛选的 IV 期患者中将 与标准化疗作为一线治疗进行比较。该研究的主要终点是总生存期(OS)。中位随访时间为15.7个月,中期分期结果显示,阿特珠单抗联合化疗使PD-L1高表达(TC3/IC3-WT)患者的中位OS达到2< @0.2 月 vs. 13.1 月(HR=0.59, 95% CI: 0.40~0.89; P=0.010 6);12个月OS率为64.9% vs. 50.6%;PD-L1高表达组中位PFS分别为8.1个月vs. 5.0 个月;12 个月 PFS 率为 36.9% vs.21.6%。ORR 为 38. 3% 与 . 28.6%,DoR 为 NE (1.8+~29.3+) vs. 6.7 个月 (2.6~23.9+)。根据研究,美国食品药品监督管理局(FDA)今年宣布批准作为PD-L1高表达转移性成人患者的一线治疗药物。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话