欢迎光临吉康旅!
分子靶向药物的问世大大改善了各种癌症的预后,但耐药性也成为当今医学界不得不面对的问题。在 2021 年 10 月举行的第 59 届日本癌症治疗学会“分子靶向耐药性和克服策略”研讨会上,庆应义塾大学校长谷川裕介表示:癌症治疗就像猫捉老鼠,随着新疗法的开发,癌症可能很快就会发展对他们的抵抗。针对目前分子靶向药物的耐药性,与会专家作了《肺癌、胃肠道肿瘤、白血病靶向药物耐药性研究现状》的专题报告。
肺癌靶向耐药策略之一:开发具有不同结合位点的下一代激酶抑制剂
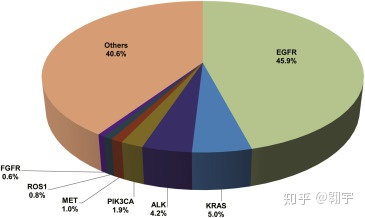
对于晚期非小细胞肺癌( )的药物治疗,一般通过伴随诊断*1确认驱动基因突变和PD-L1表达水平,从而为每位患者选择最佳的药物治疗方案。可以说,肿瘤生物标志物对于肺癌的个体化治疗至关重要。随着越来越多的驱动基因被发现,肺癌的诊断已经从传统病理学转向分子病理学。目前常见的驱动基因突变有六种,分别是EGFR基因突变、ALK基因易位、ROS1基因易位、BRAF基因突变、MET基因突变和新增的RET基因易位。与传统细胞毒药物相比,分子靶向药物靶向性更强,治疗效果更好,
注 ※1:伴随诊断( ,简称“CDx”)是一种体外诊断技术,可以为患者提供特定治疗药物的安全性和有效性信息,帮助筛选可能受益的患者,从而提高治疗效果,达到精准用药,降低医疗成本。例如,在使用赫赛汀(也称为曲妥珠单抗)之前检测 HER-2 表达水平是一种伴随诊断。
日本国立癌症研究中心东医院呼吸内科 教授表示,靶向药物的耐药机制之一是激酶位点的突变削弱了药物的结合能力。但即使在耐药的情况下,癌细胞的增殖也依赖于已知的驱动基因,因此开发具有不同结合位点的下一代激酶抑制剂有望克服肺癌的耐药问题。
EGFR突变阳性肺癌:探索奥希替尼耐药后的治疗
对于率先引入靶向治疗的EGFR突变阳性肺癌,在前半数患者对EGFR-TKI耐药后进行二次基因检测,发现一半以上(60%)患者有EGFR 激酶突变的存在会激活替代信号通路和下游信号通路以诱导耐药性(Clin Res. 2013; 19(8): 2240-7).
为克服耐药突变,以奥希替尼为代表的第三代EGFR-TKI研发成功,作用于第一代或第二代靶向药物耐药的特异性基因突变。此外,进一步研究发现,第三代靶向药物在同时存在外显子19缺失突变和EGFR突变的肺癌患者中也具有很高的活性(.2014; 4(9): 1046-61)@) . >.在奥希替尼的1期临床试验中,对既往EGFR-TKI治疗后病情进展的晚期非小细胞肺癌患者给予奥希替尼,发现阴性组的抗肿瘤作用不明显,而阳性组的客观缓解率(ORR)为61%,并且疾病无进展生存期(PFS)为9.6个月(突变阴性组为2.8个月)。西替尼治疗EGFR-TKI耐药后晚期非小细胞肺癌疗效显着,已广泛应用于临床(N Engl J Med. 2015; 372(18): 1689-9 9)。
在随后的3期随机试验中,奥希替尼被用于一线治疗晚期非小细胞肺癌,与第一代EGFR-TKI相比,可显着延长疾病无进展生存期(PFS)和总生存期 (OS) (N Engl J Med. 2018; 378(2): 113-125、N Engl J Med. 2020; 382(1)@>: 41-50).对于驱动基因突变阳性的非小细胞肺癌,从一开始就使用抗突变活性高的药物可以获得更好的抗肿瘤效果。(冲青龙教授)
当然,奥希替尼难免会出现耐药问题,而突变已被证明是奥希替尼最常见的耐药机制之一。布加替尼()与抗EGFR抗体(西妥昔单抗、帕尼单抗)联合治疗EGFR突变阳性肺癌奥希替尼耐药后的三突变(//)治疗目前正在海外多家机构进行1/2期临床试验(Nat. 2017; 8: ),第四代 EGFR-TKI 的开发也在进行中 (ESMO 2020 #, Mol Ther. 2020; 19: 2288-97).
ROS1阳性肺癌:正在研发的新一代ROS1抑制剂
其中最常见的是 ALK 抗性突变。劳拉替尼 ( ) 是第三代 ALK 抑制剂,其 ALK 二次突变也有效,已在临床推广应用。
对于ROS1阳性肺癌,第一代ROS1抑制剂克唑替尼( )对突变有活性,一半以上的耐药是由溶剂前沿耐药突变( )引起的,(JCO. 2017; 2017: PO. 1 7. )。在前期基础研究和1期临床试验中,新一代ROS1抑制剂洛普替尼( )对突变肺癌具有高活性( . 2018; 8(10): 1227-1236、@ >ASCO 2019 # 9011)@>,由日本药企主导的-1临床试验也在进行中。
多药联合抑制替代信号通路和下游信号通路的活性
研究表明,各种癌症的耐药机制与替代信号通路和下游信号通路的活性有关。例如对于BRAF突变,虽然单独使用BRAF抑制剂可以达到一定的抗肿瘤作用,但即使BRAF被抑制,肿瘤仍然可以通过ARAF和CRAF信号通路激活下游MEK,以及这种抗肿瘤治疗的效果。是有限的。因此,与恶性黑色素瘤一样,MEK抑制剂与非小细胞肺癌()联合使用,有望获得更好的治疗效果。
在一项针对 BRAF 阳性非小细胞肺癌的国际联合 II 期临床试验中,单独使用 BRAF 抑制剂 的客观缓解率 (ORR) 为 33%,无进展生存期 (PFS) 为 5%。个月 ( . 2016; 17(5): 642-50); 与 MEK 抑制剂联合使用时,客观缓解率 (ORR) 为 64%,无进展生存期 (PFS) 为 1) 0.9个月(.2017;18(10):1307-1316)。该联合疗法目前在日本获批用于治疗恶性黑色素瘤于2018年单独获批用于治疗不可切除的晚期/复发性非小细胞肺癌。
对于EGFR突变阳性的肺癌,当奥希替尼耐药时,EGFR、MET、HER2、FGFR的扩增、ALK、RET、ROS1的融合以及下游通路的激活是主要的耐药机制(Br J 201< @9.121(9): 725-737)。另外,对于ALK阳性肺癌,2代ALK抑制剂(色瑞替尼等)的MET基因扩增概率为MET第三代ALK抑制剂劳拉替尼的基因扩增概率为22% (Clin Res 2021; 27(10): 2899-2909))。在RET抑制剂-耐药性 阳性非小细胞肺癌 (Clin Res 2021; 27(1)@>: 34-42).
对于EGFR-TKI耐药且确认MET扩增的EGFR阳性晚期非小细胞肺癌,吉非替尼()联合MET抑制剂 Ni()预计具有有效的抗肿瘤作用,亚组分析( ) 发现MET扩增表达越高,抗肿瘤效果越好(J Clin .2018; 36(31)@>: 3101-3109)。另外,客观缓解率(ORR) )3代EGFR-TKI奥希替尼()联合MET抑制剂萨沃替尼()治疗奥希替尼耐药后MET扩增的患者为33%,疾病无进展生存期(PFS)为5.5个月(.2020;21(3): 373-386)。方庆龙教授说,虽然目前还不能说有很高的抗肿瘤作用,但不可否认的是,活性已经显现,这种治疗方式预计在未来还会继续。
目前,奥希替尼已经是EGFR突变肺癌患者的一线治疗药物,但很多患者最终会产生耐药性。奥希替尼耐药后的一般治疗策略是化疗,但副作用大,疗效有限。在 2021 年美国临床肿瘤学会 (ASCO) 上,报告了一种新的治疗策略。对于奥希替尼耐药的肺癌患者,继奥希替尼之后,又一个第三代EGFR-TKI——拉泽替尼联合EGFR/MET双特异性抗体——依凡珠单抗在1期临床试验中,这两种药物的联合治疗显示疗效极佳:EGFR和MET阳性患者的客观缓解率(ORR)为47%,疾病无进展生存期(PFS)为6.
新方向:耐药基因筛选研究LC--TRY正在进行中
日本国立癌症研究中心东医院呼吸内科 教授表示,对于非小细胞肺癌,应明确每种治疗的耐药机制,有助于靶向耐药后实现个体化治疗。 . 因此,当耐药发生时,通过组织学多基因检测面板(Gene)全面分析耐药机制非常重要。基于个体耐药机制,开发新药将进一步提高治疗效果。
日本国立癌症研究中心与国内外100多家机构合作,共同推进一项名为LC--TRY的联合研究。自2020年9月起,该研究对晚期/复发性非小细胞肺癌靶向治疗后的组织或血液样本进行基因分析,旨在通过筛选耐药基因进一步探索耐药机制。对EGFR突变阳性肺癌的数据进行了初步分析,也验证了此前发表的突变和MET扩增结论。
关于“对耐药突变有效的药物是应该从一线治疗开始就使用,还是应该按照指南依次给药,以达到长期治疗”的问题?例如,ALK肺癌等多重耐药突变患者,应尽可能通过活检确认突变状态,从而找到合适的靶向药物,以获得更长的无进展生存期(PFS)和总生存期。(操作系统)。另一方面,对于EGFR突变阳性肺癌中常见的突变,如果能够提前预测突变状态,开发出与结合位点相匹配的药物,就有可能获得更好的抗肿瘤效果。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话