欢迎光临吉康旅!
对于印度仿制药行业,普遍舆论认为,强制药品许可是印度仿制药行业成功的基础。但是,回顾印度的知识产权保护规定,我们会发现这可能是一个长期的误解。印度的“强制模仿”是基于国内法,而不是“强制模仿”国际公约。早在2005年,国际公约就允许成员国在特定条件下启动强制药品许可。但几十年来,我国从来没有下过命令,印度也只有一例强仿。
有很多声音建议我国及时启动药品强制许可,提高我国药品可得性。不过,《等深》记者在采访中发现,中国仿制药的研发绝非开始“强仿”那么简单。这背后的行业、市场、价格、终端等一系列因素成为中国仿制药难以“推倒”的墙。这一切都非一日之功,若要解决,也非一日之功:中国仿制药行业的发展困境不能靠单一战略解决,需要“一揽子” “处方”。
仿制药还在路上,这是当下非常无奈和紧迫的现实。
7月5日,江苏豪森药业集团(以下简称“江苏豪森”)确认获得国家食品药品监督管理总局批准下发的“伊马替尼”(商品名:信威)《药品补充申请批件》,率先在成为首家通过仿制药质量和疗效一致性评价的药企。
新威是格列卫在中国的首个仿制药,被誉为“抗癌药”。一致性评价意味着信威在质量和疗效上可与瑞士诺华制药的原研药格列卫相媲美。在招标定价方面也将享受与原研药相同的政策红利。
然而,让企业和业界欢呼雀跃的好消息几乎被同期印度廉价仿制药的热烈讨论所淹没。
格列卫由瑞士诺华公司研发,用于治疗慢性粒细胞白血病,是全球首个小分子靶向药物。
慢性粒细胞白血病是一种影响血液和骨髓的恶性肿瘤。在我国,大约有400万白血病患者,其中15%是慢性粒细胞白血病。约90%的患者被诊断为慢性期,但每年约有3%~4%的慢性期进展至急变期,急变期死亡率极高。
格列卫的问世改写了患者的生存史,将患者的5年生存率从原来的30%提高到了89%。目前,格列卫可使慢性粒细胞白血病患者的10年生存率达到85%~90%,生命周期大大延长。由于格列卫的抗癌作用,美国加快了对其上市的审批。一年多后,2002年4月,格列卫正式进入中国。
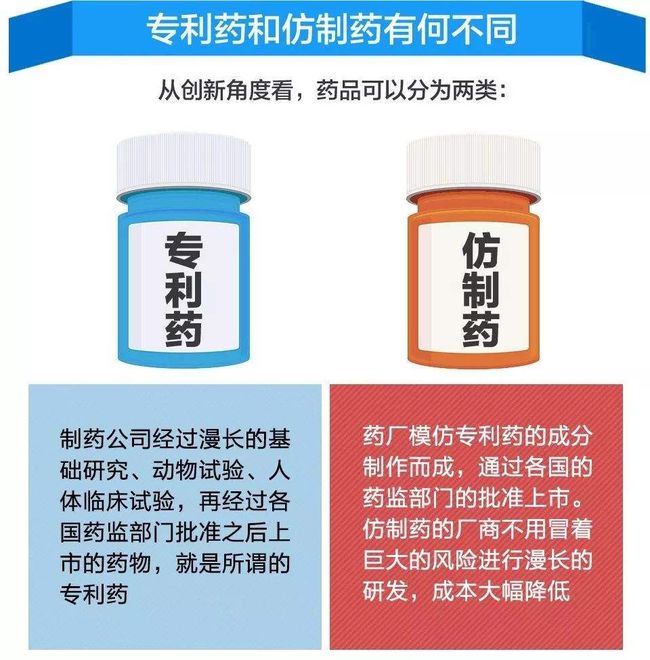
公开资料显示,在格列卫开创性的研发背后,制药企业花费了半个世纪的时间,投入了50亿美元的研发资金。创新的新药称为原研药。其高昂的研发成本通常导致极高的药品价格。
上市多年后,诺华格列卫的价格几乎势不可挡,一盒120粒的价格在人民币左右。直到2015年陆勇案曝光后,格列卫才第一次降价,从人民币降到人民币。
格列卫进入中国后的第二年就加入了中华慈善总会的患者救助计划,后来发展为买3送9,大大减轻了中国患者的药费负担,但在进入医保之前,每年的负担患者仍然花费 6.60,000 到 7.20,000。
2013年4月2日,格列卫在中国的专利到期。随后,国产仿制药陆续上市,开始抢占市场。
根据国际通行做法和我国专利保护制度,仿制药只有在原研药专利期满后才能上市。
格列卫专利到期后不久,首个仿制药信威上市。2014年,正大天晴药业集团伊马替尼胶囊上市,商品名为吉尼奇。2015年,石药集团推出商品名为诺林宁的伊马替尼片。
信威的上市价格要“亲民”得多,只有格列卫的十分之一。
目前,从各省药品招募平台的价格来看,国产格列卫三款仿制药的价格几乎是诺华格列卫的一半甚至更低。以北京标价0.1g×60片为例,江苏豪森信威的价格为1160元/盒,正大天晴的价格为872元/盒,石药的诺林宁价格为949元/盒。
在全球医药领域,制药企业依靠药品专利保护,在一定时期内独家垄断市场,获取巨额利润。但随着专利保护期到期,仿制药进入市场,原药企业的销售收入和利润就会出现。显着减少。这一现象被形象地比喻为“专利悬崖”。
然而,在我的国家,格列卫不遵循这个一般规则。仿制药上市多年后,原研药仍占据大部分市场。
相关数据显示,2016年诺华的格列卫(销售额15.4亿元)市场占有率最高,为80.29%,是国内其他三大仿制药的总份额药物。4次。
不仅如此,国产仿制药也受到了印度仿制药的冲击。根据我国现行相关规定,印度制造的“格列卫”尚未获得我国批准进口。因此,海外代购成为了很多人的选择。
印度某知名药企生产的仿制格列卫,0.1g×120片,售价不到1000元,赛诺的仿制格列卫伊马替尼更便宜,团购价格最低可达200元/片盒子。
按每月120片“格列卫”的治疗量计算,印度仿制药每年只需2400元,相当于国产“格列卫”一个月的费用,而诺华格列卫也只有几十个。一部分。
陆勇认为,与骨髓移植相比,长期食用印度“格列卫”可以让他“正常”地生活。
2013年被警方抓获前,患有慢性粒细胞白血病的企业主卢勇长期服用在印度购买的仿制药“格列卫”,治疗效果显着。此后,受数千名患者的委托,他帮助在印度购买了“格列卫”。但2014年,陆勇因“妨害信用卡管理罪”和“销售假药罪”被起诉。2015年1月29日,陆勇被无罪释放。
“我吃了3年药,吃掉了我的房子,毁了我的家人。” 在格列卫被纳入医保之前,这部电影的台词也是我国众多慢性粒细胞白血病患者的真实写照。
据了解,格列卫因其对慢性粒细胞白血病的特效药,为诺华带来了巨额收入。自上市以来,全球总收入已达数百亿美元。
而诺华格列卫只是印度“世界药房”中的抗癌仿制药之一。
据介绍,印度医药工业年产值占全球医药工业的3.1%~3.6%,产量约占10%。仿制药约占国内药品生产部门的 71%,是印度制药业的最大组成部分。目前,印度仿制药出口到全球200多个国家,2017-2018财年出口额为1.72.7亿美元。
虽然印度目前是全球第二大医药市场,也是全球最大的仿制药生产基地之一,但印度在中国市场的医药市场份额并不高。我国很多传染病和重症患者对购买印度仿制药的需求很大。
国内普遍分析认为,印度仿制药产业之所以发展,是因为印度实行了药品强制许可制度,也就是俗称的“强仿”。
然而,私人智库公共卫生治理项目执行主任、德克萨斯州圣玛丽大学法学院兼职教授贾平认为,这在中国是长期存在的误解。
贾平长期致力于国内外公共卫生领域的政策研究。他告诉《》记者,印度实行的仿药制度是在国内法律和知识产权保护范围内的仿制,而不是国际公约规定的强制仿制。迄今为止,印度仅通过颁发强制药品许可生产了一种仿制药。
所谓强制许可,简单来说就是一国政府在未经专利权人同意的情况下,允许第三方生产专利产品或使用专利方法的法律制度。
国际上对药品强制许可的实施争论了多年,终于达成了共识。
由于1994年签署的《与贸易有关的知识产权协定》(以下简称“协定”),过分强调药品专利保护和专利独占性,导致专利药品价格居高不下,严重影响了发展中国家获得公共卫生的机会药物。.
从那时起,世贸组织成员一直致力于在专利保护和公共卫生之间寻找新的平衡点。
2001年,《多哈公共卫生宣言》确认各国在国家紧急情况下有权使用强制许可,通过强制仿制药获得低成本仿制药;各国有权决定什么是"国家紧急状态"。紧急状态或其他极端紧急状态”,由艾滋病、疟疾等传染病引起的公共卫生危机,就构成了这种“紧急状态”。
2005年通过的《协议修正议定书》(以下简称《议定书》)对协议进行了首次修订,进一步规定发展中成员和最不发达成员可能因艾滋病、疟疾等出现国内公共卫生问题、肺结核等流行病。在危机时期,未经专利权人许可,我国实行专利强制许可制度,从其他实施强制许可的成员生产、使用、销售或进口与治疗上述疾病有关的专利药品系统。
“这不仅将大大降低相关专利药的市场价格,也有利于更快速有效地控制和缓解公共卫生危机,也为发展中国家实施仿制药强制许可扫清了法律障碍。” 全国政协委员、中国疾病预防控制中心艾滋病首席专家邵一鸣告诉记者。
“强制许可的实施必须有一个先决条件,即认定一种疾病已在一个国家造成大规模公共卫生危机,将该国置于紧急状态。但《多哈宣言》和《议定书》都没有明确什么标准是公共卫生危机,这为每个国家实施强制许可留下了机会,即每个国家定义自己的国家是否处于公共卫生危机中。”贾平说,强制模仿必须取得国家强制许可,才能实施。
公开资料显示,2012年3月9日,印度专利局向当地一家仿制药公司颁发了该国第一个强制许可,目标是德国拜耳抗癌药“”(英文商品名)。尽管德国拜耳公司提出抗议,但来自仿制药的竞争使该药在印度的价格大幅下降至每月 175 美元,降幅接近 97%。
但政府决定,该公司将向拜耳支付该药物净销售额的 6% 作为特许权使用费。

尽管自2012年以来,已有多家印度公司申请强制许可,如仿制罗氏()的乳腺癌重磅药赫赛汀()、百时美施贵宝(BMS)的白血病药等,但印度专利局均使用药品公司以未提供确凿证据为由驳回了强制许可申请。印度当局所依据的法律是 1970 年《专利法》。
1970 年《专利法》第 92 条规定,在“国家紧急情况”、“极端紧急情况”或“公共非商业用途”的情况下,印度专利局局长可根据中央发出的通知政府自行颁发强制许可。
该条款要求印度政府将此类极端情况告知公众,之后任何相关方均可申请强制许可。印度专利局局长可以按照他认为适当的条款和条件向申请人授予强制许可。
事实上,1970年的《专利法》不仅规定了强制许可的实施,也为印度制药企业仿制药品提供了最早、最宽松的法律依据。
1970年的《专利法》将药品专利分为产品专利和方法专利。同时规定,药品、食品、农药等产品本身不能申请专利,只能对上述产品的生产工艺申请专利。
根据印度现行法律,印度政府允许国内制药企业在未经专利权人同意的情况下,模仿药品的化学成分,改变制药工艺,生产出符合其安全性和有效性、质量、功能和性能的药品。原药。适应症与其他仿制药相同。
“在法律层面起诉仿制药过程更加困难。” 上海科迪健康管理咨询有限公司创始人兼CEO杨晨说。
不仅如此,印度还获得了国际组织的超长宽限期,推迟10年执行1994年签署的协议。
从1970年到2005年,在30多年的国内政策和国际恩典支持下,印度制药业完成了大宗原料药、特种原料药、仿制药、仿制药、新专利药的产业升级路线。
印度制药业利用自身的低成本优势,即研发成本几乎为零、超低的产线建设成本和人工成本,实现了快速升级。
2005年后,印度的大型制药公司已经完成了国际化经营的进程。
今天,印度拥有世界顶级的仿制药公司。据统计,2017年全球仿制药企业前七名中,印度占了两家。
值得一提的是,印度的仿制药并没有停留在低端仿制,而是占据了高端仿制药的制高点,仿制了大量乙肝、丙肝、肝癌等传染病。 、肺癌、肠癌、乳腺癌等治疗严重疾病的药物。
然而,印度并不是仿制药的“天堂”,仿制药的质量正在遭受冲击。
据了解,近年来,印度生物一致性评价和生物利用度研究的数量有所增加。原因之一是印度政府对仿制药质量监管松懈,相关数据收集不透明,使得药品质量难以令人信服。
2017年的一份相关报告称,15年前,美国食品药品监督管理局(FDA)并未在印度进行任何生物利用度或生物身份评估检查。如今,近一半的 FDA 检查是在印度进行的。
我国是制药大国,仿制药占据绝对比例。
据统计,截至2017年底,我国共有原料药及制剂生产企业4376家,其中90%以上为仿制药企业。在近17万个药品批次中,95%以上为仿制药。
2017年,我国仿制药市场规模达到5000亿元左右,约占药品市场总量的40%。
但我国不是仿制药的强国。
中国医药企业管理协会会长郭云培告诉《》记者,我国医药企业存在“多、小、散、乱”等问题,国外大型医药企业只有几十家。
“中国已经成为世界上最大的制药国之一,但它只是仿制药和原料药的生产大国,”郭云培说。
仿制药的批号那么多,但我国的仿制药在世界上没有足够的发言权。
阻碍仿制药行业发展的一个重要因素是仿制药与原研药之间的差距。
“过去我国仿制药水平很差,主要是解决缺药缺药的问题。大部分仿制药没有达到疗效,药效与原来相差甚远药品,并没有相应的规范和标准,但2008年后市场上的仿制药发生了变化。” 郭云培说,我国仿制药水平与发达国家还有很大差距。
为提高我国医药产业整体水平,保障药品安全有效,促进医药产业升级和结构调整,2015年,我国启动了仿制药一致性评价工作。
2016年,《国务院办公厅关于开展仿制药质量和疗效一致性评价工作的意见》明确,2007年10月1日前批准上市的《国家基本药物目录》中化学药品必须重新进行一致性评价,并于2018年底前完成。逾期不合格的,取消其药品生产批件。
仿制药一致性评价是指按照与原研药质量、疗效一致的原则,分阶段、分批对获批的仿制药进行质量一致性评价。s 水平。
根据国家食品药品监督管理总局关于一致性评价的规定,通过一致性评价的仿制药将获得适当的医保支付支持等优惠条件。
据统计,截至2018年底,共有1800多家医药生产企业,涉及化学药仿制药口服固体制剂289个,涉及批准文号1个,占所有化学制剂生产企业的61.7%。
据了解,2007年上市的仿制药没有与原研药进行一致性评价的强制性要求。
我国《药品注册管理办法》规定,仿制药应具有与仿制药相同的活性成分、给药途径、剂型、规格和相同的治疗效果。对于多家公司生产的品种,应参照相关技术指南选择仿制药进行比较研究。
这也意味着仿制药的比较研究对象不一定要以原研药为基础。
中国医药创新促进会执行会长宋瑞林曾表示,在我国,除了首仿要求遵循创新药标准外,其余均以“国家标准”为准。但是,“国家标准”没有统一的标准,在很大程度上加剧了重复申报。
没有统一标准的另一个后果是仿制药水平降低。
据介绍,一般情况下,一次仿制只能达到原研药的80%,二次仿制只能达到一次仿制的80%……这样仿制药的质量和疗效就会不如第一代。
有一个极端的案例可能会有所启发。据某医药界知名院士介绍,国内仿制同一种胃药的药厂有几十家,只有一家药效与国外相近,其余安全无效,甚至安全有效。无效。
对仿制药进行一致性评价是国际惯例。历史上,美国、日本等国也经历过同样的过程。日本花了十多年的时间来推动仿制药的一致性评价。
国内药企的产业格局可能因仿制药一致性评价而改变。有分析认为,一致性评价将增强我国仿制药在全球的话语权,未来50%的药品审批将被淘汰。
在郭云培看来,仿制药行业的良好发展也会增强原研药的议价能力。
“仿制药的价格也需要通过市场机制进行调整,只有随着市场的扩大和高水平仿制药的量产,原研药的价格才能被迫降低。” 郭云培说道。
然而,预期推动行业供给侧改革的一致评价并不顺利。
据国家食品药品监督管理总局公告,截至7月26日,已有57个口服制剂品种通过仿制药质量和疗效一致性评价。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话