欢迎光临吉康旅!
作者 |马飞
生物医药加速超车,齐鲁破局,百奥泰减肥,罗氏压力山大……
01
生物制药领域的暗流
最近,生物仿制药领域风起云涌。
进一步看,韩国制药公司宣布,截至今年第二季度,其利妥昔单抗生物仿制药在英国、法国、意大利、德国和西班牙的市场份额合计为 46%。它约占欧洲利妥昔单抗市场的 70%。
从整个欧洲市场来看,该药的份额也超过了40%,欧洲市场又一个原研药被同类药赶超。
细看国内市场,竞争更加激烈。
以贝伐单抗为例,生物类似药百花齐放,已形成“1+6”格局:贝伐单抗的生物类似药刚刚获批。
此前,罗氏的贝伐单抗获批用于妇科肿瘤的两个新适应症,而百奥泰的贝伐单抗生物类似药获批用于非小细胞肺癌和结直肠癌。
国内也有齐鲁、信达、绿叶、恒瑞等强者。今年上半年,在重点省市公立医院西药销量前10名中,齐鲁的贝伐单抗增长最快,市场份额已超过原研药,20余家企业如复宏汉霖和康宁杰瑞还在这个领域竞争,竞争异常激烈。
这表明生物仿制药在全球范围内呈上升趋势,尤其是在中国。
02
卡槽战的情况很着急
目前,临床上销售的重磅生物药正面临同类药物的全面冲击。
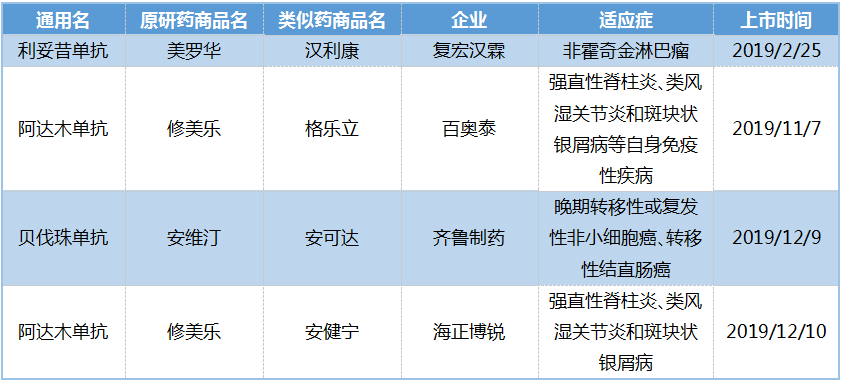
利妥昔单抗生物仿制药赶上了欧洲的鼻祖。在中国,继复宏汉霖的利妥昔单抗生物类似药于2019年在中国获批上市后,国内首个生物类似药打破了原研药长达十余年的市场垄断。信达随后跟进,相关临床试验10余项,临床Ⅲ期及以上7项。
由此带来的情况是,截至今年上半年,首个利妥昔单抗生物类似药已在全国30个省市完成医保开通,70%以上的核心医院实现药物输送。销售额快速增长,中国原研药销售额下降23%。
不仅如此,全球对利妥昔单抗的竞争也愈演愈烈。
在生物仿制药最成熟的欧洲市场,首个获批的利妥昔单抗生物仿制药已超越原研药。
分析欧洲替代曲线可以看出,首个生物类似药在上市5年后平均占据40%以上的市场份额(包括原研药和生物类似药)。平均而言,率先上市的生物仿制药在欧洲生物制剂市场具有先发优势,最新数据丰富了曲线。
国内首个利妥昔单抗生物类似药也已在哥伦比亚、秘鲁、厄瓜多尔、委内瑞拉等拉美国家布局,生物药的全球竞争更加充分。
同样情况下的生物药是贝伐单抗。
截至今年11月,在FDA批准的31种生物类似药中,贝伐单抗类似药尤为抢眼。新获批的and:前者在2019年专利到期后正式在美国销售,市场排名第二。 2020年实现收入7.98亿美元;后者在 2020 年第一年的销售额达到 43 亿美元。这些同类药物给原研药带来了巨大的竞争压力。
表1 上半年重点省市公立医院西药销售额前10名
在中国,在已上市的贝伐单抗中,原研药和齐鲁生物类似药各有优势,其他产品因商业化布局尚处于起步阶段,市场占有率较低。
从趋势来看,后发者可能会通过适应症的差异化策略进行突破。例如,贝达和复宏汉霖选择了转移性结直肠癌的适应症,这与已在中国上市的生物仿制药贝伐单抗不同。或向海外延伸,如信达积极布局美国、加拿大、印度尼西亚等海外权益。
Bio-Tech与诺华子公司合作,在欧美、加拿大等国际市场拓展贝伐单抗类药物,全面、多维度的竞争格局迫在眉睫。
阿达木单抗方面,近年来艾伯维全球销量有所增长,但国内销量逐渐下滑,销售规模远低于欧美市场,替代潜力也很大。
Bio-Tech、等公司已处于领先地位,46项临床试验仍在进行中。阿达木单抗等重磅生物药的分化正在加速。在价差逐渐缩小的情况下,迹象成为取胜的关键。目前,阿达木单抗国内适应症不多,所以生物类似药在这场竞争中。在“丛林法则”竞赛中表现出色。

03
同质化加剧,市场取代拼搏速度
虽然生物仿制药受到关注,但这并不是一场机会均等的盛宴。如果我们专注于中国市场,观察这种竞争格局,我们将成为未来的竞争堡垒。
首先,生物类似药的临床应用逐渐得到认可。 CDE发布的《生物类似药相似性评价和适应症外推技术指导原则》强调,通过对拟外推适应症相关研究数据和信息的科学论证,支持其在中国批准用于其他非定向药物的参考药中。研究适应症。
在这种情况下,生物类似药的开发需要差异化适应症策略和开发速度的比较优势。
同类药物在欧洲的平均市场份额为44.1%,后来者在抢占市场方面略显薄弱。例如,EMA批准的第二个生物类似药进入欧洲市场后,在与原研和第一个生物类似药的竞争下,第一年将抢占0.7%的市场份额,第二年上市。市场份额占比升至3.4%,但在上市后第二年不到原研药市场份额的1/3。
以此类推,国内生物制药市场也将面临同样的考验。
图1不同靶点的临床试验次数
2020年国内药物临床试验2602个,比上年增加9.1%,国内申办者占比超过70%,前10名标的中有9个集中在同一适应症,7个靶点的药物品种90%以上的适应症集中在抗肿瘤领域。
这说明,肿瘤药物创新繁荣的背后,谁能比别人领先一步获批上市,关系到市场的成败。
挑战者在现实中面临新的挑战:受试者招募日益成为影响临床试验速度的关键因素。
目前PD-1、等靶标品种临床试验60余项;此外,6个靶点的药物I期临床试验比例超过40%,而II期临床试验各靶点的比例不高,PD-等靶点的III期临床试验多达20个。 1、.
表2 临床试验目标人群分布
官方披露,2020年注册的临床试验中,在临床试验获批后一年内招募的受试者不到一半(45.4%); I期临床试验是主要的。 2020年药物临床试验仍以国内临床试验为主,占比91.6%,国际多中心试验仅占8.1%,包括生物类似药在内的国内竞争,包括药品,会更加激烈。
目前,贝伐单抗、曲妥珠单抗等上述热门同类药物的临床研究正在向海外延伸。而在国内不招募受试者或仅在国外进行的单中心临床试验,比例仅为0.3%;国际多中心试验比例较高,为14. 1%。
许多公司报告称“临床试验的时间成本和机会成本正在增加”。学科资源的短缺势必会影响项目的速度和空间占用。
04
成本优势获胜并最大化覆盖范围
虽然对于生物类似药的临床应用仍有不同的看法,虽然已经证实生物类似药与原研生物药的安全性和有效性没有显着差异,但客观上来说,临床药物互换的研究普遍还有待加强。
有限的临床证据也会影响对临床使用的态度。有专家建议,在政策上,应鼓励企业报告上市后生物类似药和原研生物药在不同转化情景下的患者安全性和免疫原性数据。
另外,胰岛素大量采购后,生物药集中采购的规模肯定会扩大。
因此,产品上市后,成本优势和产品覆盖能力都需要检验。在保证高质量的同时,争取成本优势将是大势所趋。
近期,默克与博安生物的平台技术和产业链合作,利用自身在抗体增强工艺、连续工艺设备、经济培养基开发等方面的优势,进一步提高生产效率,优化生产。成本,这次合作远超单品的商业价值。
博安生物的贝伐单抗生物类似药“虎前行,后追兵”,其商业化策略是除了自建商业团队外,选择与阿斯利康合作,并授权后者经营该药在中国21个省市地区的县区独家推广,通过资源协同实现产品覆盖面最大化,是生物类似药竞争战略的重要切入点。
Bio-Tech 也知道这一点。
今年年初,它无奈地连续砍掉了2个ADC药物研发项目,专注于瘦身行动。其2021年中报显示,在研的13个药物中,贝伐单抗、托珠单抗、斯库奇宇单抗和戈利木单抗4个生物类似药累计研发投入达11.3亿元,占比近75%研发总支出。同类最佳。
去年8月,授予百济神州贝伐单抗在中国的商业化权,寻求更大的渠道覆盖。能否冲出“丛林”,还有待市场检验。
随着跨国公司在中国的可持续发展,它们将逐步加强以中国为中心的本土化,中国创新企业将逐步走向国际化,以实现可持续发展。生物药之间的竞争也将变得更加复杂。有了产品,也考验着企业的综合实力。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话