欢迎光临吉康旅!
*仅供医疗专业人士阅读和参考
提示
: 恶性胸膜间皮瘤放疗后手术可取得良好效果
CCR:雷莫芦单抗联合奥希替尼治疗EGFR突变阳性安全有效
JHO:对复发性或难治性外周 T 细胞淋巴瘤安全有效
新药:NMPA接受新的适应症 信迪珠单抗联合贝伐珠单抗治疗一线肝癌患者
新药:KRAS抑制剂,有望成为突破性疗法
01
: 恶性胸膜间皮瘤放疗后手术可取得良好效果
1月12日,《华尔街日报》在线发表了一项单中心II期临床研究结果,结果显示,恶性胸膜瘤患者放疗后行胸膜外全肺切除术,可获得良好的早期和远期疗效。但是,在使用该治疗方案时,仍需尽量减少4级不良事件的发生,这可能会影响患者术后的生存率。
文章发布截图
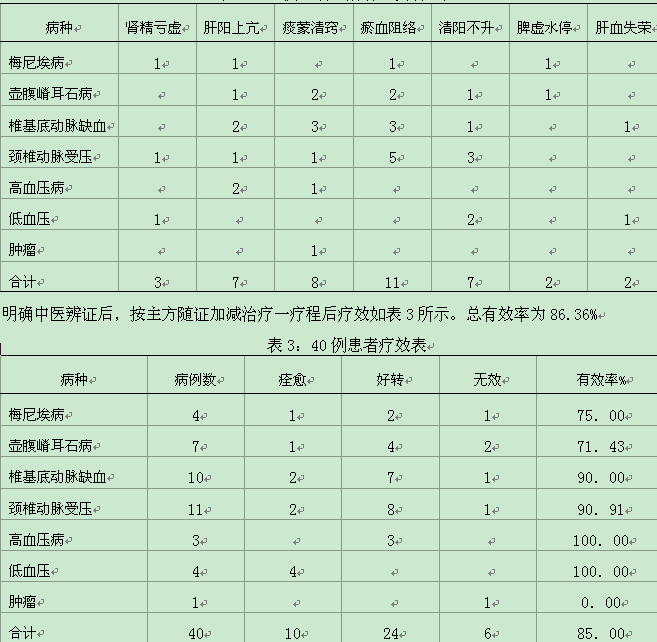
放疗后间皮瘤的手术治疗是恶性胸膜间皮瘤的一种新型治疗方法。治疗过程是对半胸进行短期、高剂量强化放疗 (IMRT),然后进行胸膜外全肺切除术。该研究的主要目的是评估这种治疗的临床可行性。
该研究共纳入了 96 名接受治疗的患者。研究发现,从完成 IMRT 治疗到接受胸膜外全肺切除术的平均时间为 5 天。47 名 (49%) 患者在围手术期 30 天内出现 3-4 级不良事件,1 名患者 (1%) 在围手术期 30 天内死亡(5 级不良事件,肺炎)。平均随访46.8个月后,5年远处复发累积发生率为63.3%。最常见的第一转移部位是对侧胸腔 (46%) 和腹腔 (44%)。
综上所述,本研究发现对于恶性胸膜间皮瘤患者,放疗后胸膜外全肺切除术可以提高早期和远期疗效。
02
CCR:雷莫芦单抗联合奥希替尼治疗EGFR突变阳性安全有效
目前已报道的一项临床试验结果显示,靶向雷莫芦单抗联合EGFR酪氨酸激酶抑制剂(TKI)奥希替尼用于治疗EGFR突变阳性的非小细胞肺癌()。疗效和安全性可控。
文章发布截图
该研究纳入了 25 名 EGFR 突变阳性患者,这些患者之前接受过 EGFR TKI 治疗并出现疾病进展,但未使用过第三代 EGFR-TKI。在根据需要减少剂量限制毒性 (DLT) 期后,该队列被扩大。患者接受奥希替尼和雷莫芦单抗直至疾病进展或治疗结束。
结果 未观察到 DLT,中位随访时间为 25.0 个月。3 级或更高级别的常见治疗相关不良事件 (TRAE) 是高血压 (8%) 和血小板计数减少 (16%);1 名患者出现 5 级 TRAE(硬膜下出血)。有(N=10) 或无(N=15))中枢神经系统(CNS)转移的患者具有相似的安全性结果,5 名患者仍在接受治疗。
客观缓解率 (ORR) 为 76%,中位无进展生存期 (PFS) 为 11.0 个月(90%CI 5.5-19.3). 在有和无中枢神经系统转移的患者中,观察到的 ORR 分别为 60% 和 87%;中位 PFS 分别为 10.9 和 14.7 个月。对于循环肿瘤 DNA 探索性生物标志物分析表明,基线时检测到的 EGFR 外显子 19 缺失或突变与更长的 PFS 相关,但突变并非如此。
以上结果表明,联合奥希替尼治疗晚期EGFR突变阳性具有良好的疗效和安全性。

03
JHO:对复发性或难治性外周 T 细胞淋巴瘤安全有效
目前,&&报道的一项开放标签II期研究表明,PD-1抑制剂()对复发性或难治性外周T细胞淋巴瘤(r/r PTCL)具有良好的疗效和可控的安全性。该研究的主要作者是中国医学科学院肿瘤医院石元凯教授。
文章发布截图
中位随访时间4.06个月(范围0.30-22.9)。在可评估的89例患者中,36例达到客观缓解(4 0.4%, 95%CI 30.2-51.4),其中13例(14.6%)完全缓解, 23例(25.8%)部分缓解,中位缓解持续时间(DOR)为11.4个月(95%CI 4.8-未达到)。
与PD-L1表达<50%的患者相比,PD-L1表达≥50%的患者从治疗中获益更多(ORR:53.3% vs 25.0%,p=0.013;中位 PFS:6.2 个月 vs 1.5 个月,p=0.002)。
在安全性方面,26名患者(25.5%)有≥3级TRAE,最常见的是淋巴细胞计数减少(n=4)和血小板计数减少(n=3)) @>. 45例患者(44.1%)出现严重不良事件,其中19例(18.6%)与治疗有关。
以上结果表明,它在r/r PTCL患者中显示出良好的疗效和可控的安全性。PD-1 抑制剂有望为该患者群体提供一种新型治疗方法。
04
新药:NMPA接受新的适应症 信迪珠单抗联合贝伐珠单抗治疗一线肝癌患者
今日,信达生物宣布,国家药品监督管理局(NMPA)正式受理了创新型PD-1抑制剂信迪珠单抗联合贝伐珠单抗治疗一线肝癌患者的新适应症新适应症。
这一新适应症申请基于一项随机、开放、III 期对照临床研究(-32)- 联合贝伐珠单抗治疗不可切除或转移性肝细胞癌,基于独立数据委员会(iDMC)对中期分析,信迪利单抗联合贝伐珠单抗治疗与索拉非尼单药治疗相比,显着延长了总生存期(OS)和PFS,达到预设的优势标准。
05
新药:KRAS抑制剂,计划纳入突破性疗法
1月12日,NMPA药物审评中心(CDE)在官网宣布,拟将百济神州/安进公司的KRAS G12C抑制剂纳入突破性治疗方案,拟适应症为:已接受至少一个系统的治疗。过去在性治疗中具有 KRAS p.G12C 突变的局部晚期或转移性患者。
AMG 510 是第一个进入临床研究的 KRAS G12C 抑制剂。在2019年美国临床肿瘤学会(ASCO)年会上,公布了AMG 510的首个I期临床研究进展。该研究共纳入35例患者(14例,19例大肠癌,2例阑尾癌),最终可评估29例(10例,18例大肠癌,1例阑尾癌)。
10例可评价患者中,治疗后部分缓解(PR)5例,病情稳定(SD)4例,疾病控制率(DCR)达90%(9/10),有效)率 (ORR) 达到 50%。
参考资料:
[1] BC John Cho,, A, et al. for():从一个-,2.的。在 12, 2021.DOI: (20)-9.
[2] A. Yu, Luis G. Paz-Ares, Chih-Hsin Yang,et al. I 和 in 与 in-EGFR-非细胞肺。在 12, 2021.DOI: 1 0.1158/1078-0432.CCR-20-1690.
[3] 石,吴,王振,等。and of () for or T cell: an open- 2 (-002).: 12 2021.
[4]
[5]
本文首发:肿瘤内科频道
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话