欢迎光临吉康旅!
编译丨柯柯/
9月21日,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)就药物审评发表多项积极意见,建议在欧盟批准阿斯利康/默克()联合贝伐单抗用于同源重组缺陷(HRD)阳性晚期卵巢癌患者的一线维持治疗,罗氏抗PD-L1疗法(阿特珠单抗)联合(贝伐单抗)单克隆抗体治疗不可切除或转移性成人患者既往未接受过全身治疗的肝细胞癌(HCC)患者,以及公司新的100 mg/mL静脉注射(IV)改良配方。
01、
CHMP 建议联合贝伐单抗治疗晚期(FIGO III 和 IV 期)晚期卵巢上皮癌、输卵管癌或原发性腹膜癌。这些患者在完成一线铂类化疗联合贝伐单抗后出现(完全或部分)缓解,并检测出乳腺癌易感基因 1/2(/2)突变和/或与HRD 阳性状态。
CHMP 的积极意见是基于发表在《新英格兰医学杂志》上的双盲 3 期临床研究 1 的生物标志物亚组分析结果。贝伐单抗维持治疗可将疾病进展或死亡风险降低 67%(风险比 0.33;95% CI 0.25-0.45)。 HRD 阳性晚期卵巢癌,联合治疗可将无进展生存期 (PFS) 提高 37.2 个月,而单独使用贝伐单抗的患者为 17.7 个月。
最近在 2020 年 ESMO 网络大会上,-1 试验更新了更多数据。结果表明,与单独使用贝伐单抗相比,联合贝伐单抗维持治疗可显着改善 HRD 阳性晚期卵巢癌患者的继发疾病进展时间(PFS2)),这是一个关键的次要终点。联合贝伐单抗将患者的 PFS2 提高至 52)@0.3 个月,而贝伐单抗组为 35.3 个月。
02、
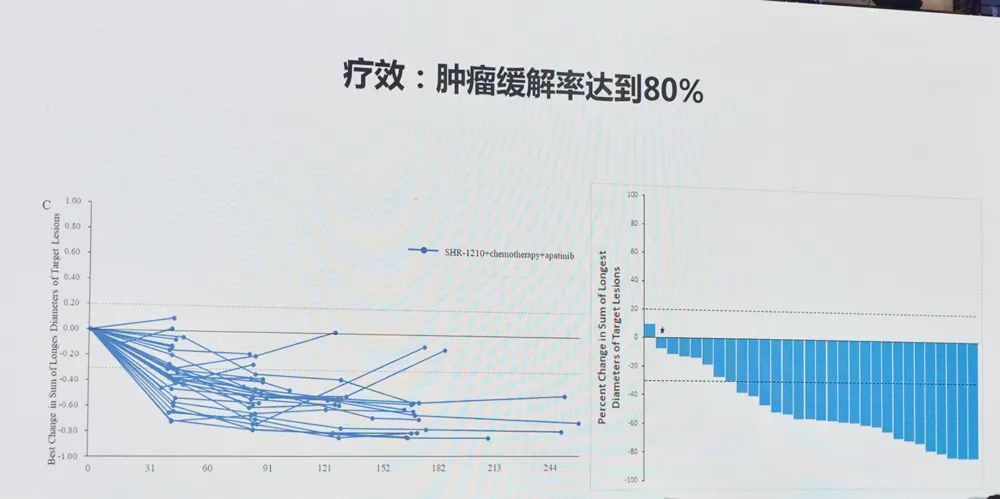
CHMP 对成人 HCC 患者联合抗 PD-L1 治疗的积极意见是基于 3 期研究的结果,这是第一个 III 期癌症免疫治疗研究,显示不可切除或转移性 HCC 患者表现出显着改善在 OS 和 PFS 方面与抑制剂索拉非尼比较。
试验数据显示,与索拉非尼组相比,+联合治疗组总生存期显着延长,死亡风险降低42%(HR=0.58, 95%CI:0.@ >42-0.79, p=0.000 6),显着延长无进展生存期 (PFS),疾病进展或死亡风险降低 41% (HR=0. @>59, 95%CI:0.47-0.@ >76, p<0.0001).
今年5月,+组合获美国FDA批准用于治疗既往未接受过全身治疗的不可切除或转移性疾病 值得一提的是,+组合是首个获批用于治疗的癌症免疫治疗方案不可切除或转移性 HCC。
03、
第一个也是唯一一个长效 C5 抑制剂每 8 周给药一次,用于治疗阵发性睡眠性血红蛋白尿 (PNH) 和 SARS 型溶血性尿毒症综合征 (a HUS) 两种超罕见疾病。在体重小于 20 公斤的儿科患者中,每 4 周进行一次静脉注射。与之前的配方相比,10 mg/mL、100 mg/mL的平均年输注时间减少了约60%,同时具有相当的安全性和有效性,改善了aHUS和PNH患者的治疗体验。在 100 mg/mL 之后,大多数患者每年接受的治疗时间不超过 6 小时。
CHMP 的积极意见基于综合化学、制造和控制 (CMC) 报告和补充临床数据集。该数据集在使用 10 mg/mL 和 10 mg/mL 后显示出相当的安全性、药代动力学和免疫原性。同样,数据集显示对两种配方中平均乳酸脱氢酶 (LDH) 水平的功效测量没有显着影响。与目前可用的 10 mg/mL IV 输液配方 [输液时间从<@与1.3-3.3小时(77-194分钟)]相比,输液时间缩短了一半以上。
用于 PNH 和 aHUS 治疗的皮下制剂和设备组合计划于 2021 年第三季度提交给美国和欧盟的药物监管机构,新设备允许患者在家中自行用药,目前正在进行第 3 阶段临床研究和 12 个月安全性数据的收集。
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话