欢迎光临吉康旅!
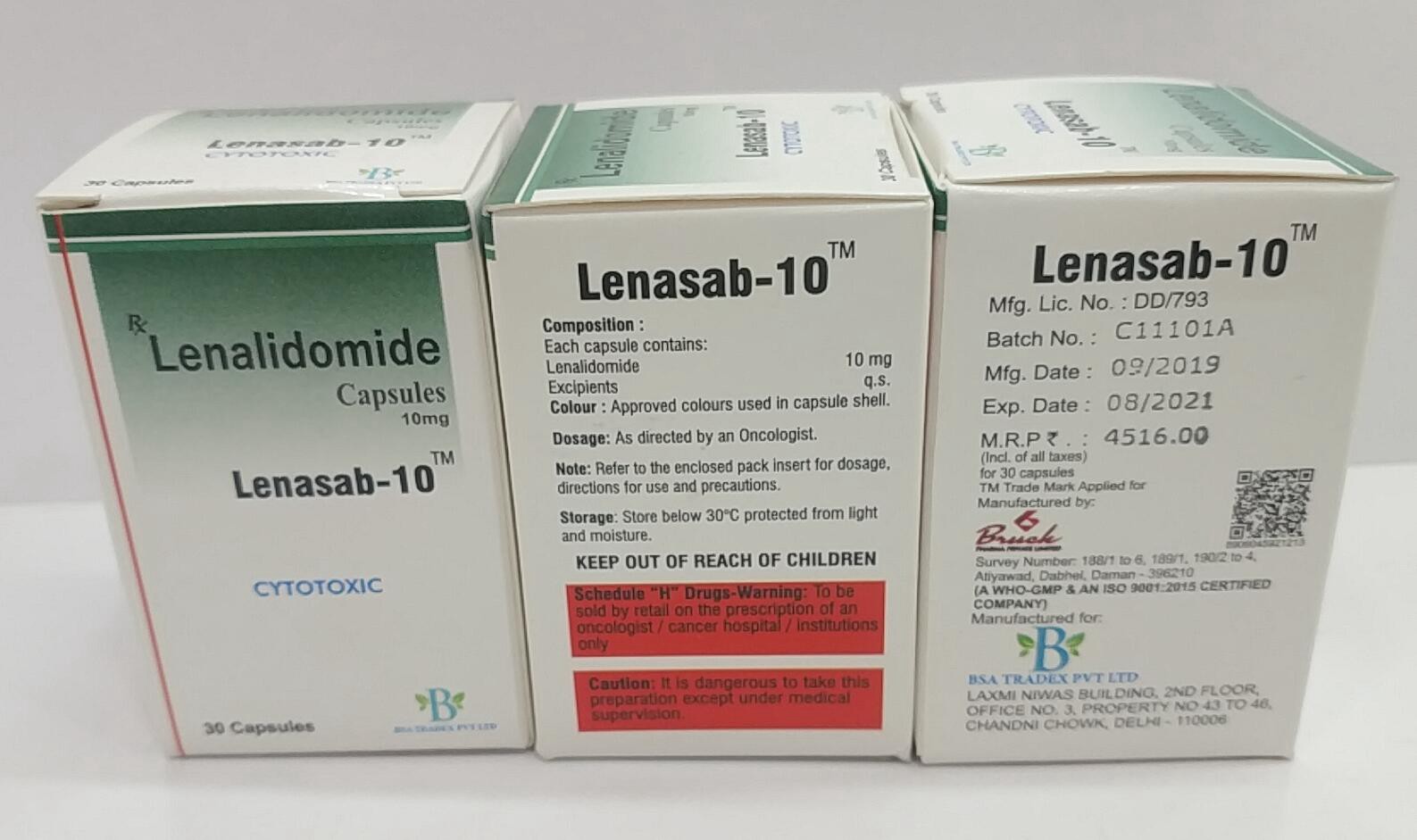
伊布替尼或依鲁替尼(Ibrutinib), 原研药由艾伯维 AbbVie/强生 (Janssen) 推出,药名叫亿珂(Imbruvica)。
美国FDA批准依鲁替尼胶囊可用于临床治疗:
1、慢性淋巴细胞白血病(CLL),
2、小淋巴细胞淋巴瘤 (SLL);
3、巨球蛋白血症 (Waldenstrom);
4、外套细胞淋巴瘤 (MCL);
5、MZL 边缘区淋巴瘤 (MZL)
6、难治性硬皮病样慢性移植物抗宿主病(cGVHD)
2016 三月,美国FDA核准 Ibrutinib 用于第一线治疗 CLL, 2017年 FDA再核准 imbruvica 用于治疗 cGVHD.依鲁替尼(Ibr)是一种已被批准用于治疗CLL(包括伴del17p)患者的BTK抑制剂。艾伯维Venetoclax(ven)是一种获FDA批准用于治疗伴del17p的复发性CLL患者的BCL-2抑制剂。
早期研究显示,Ibr联合ven具有协同抗肿瘤活性,在加用ven之前引入ibr单药或可通过消除肿瘤细胞,进而降低肿瘤溶解综合征 (TLS)风险。
在药试期间采用了PCYC-1142 (CAPTIVATE),这是一项多中心2期临床试验 (NCT02910583),该试验应用ibr联合ven (I+V)作为CLL的一线治疗方案,旨在评估I+V治疗后获得MRD(-)缓解是否能延长患者无治疗间歇。
按照国际慢性淋巴细胞白血病工作组(IWCLL)标准诊断为CLL/SLL的70岁以下的初治患者接受ibr单药 420 mg/d PO导入治疗3个月,随后给予ven逐渐加量至400 mg/d PO.6周期 I+V治疗后,评估外周血MRD (<0.01% 流式细胞检测)。 12周期 I+V治疗后,根据MRD状态定期评估MRD和骨髓缓解情况。
该研究共入组163例患者 (中位年龄58岁;del17p占14%,del11q占15%,最大淋巴结直径[LDi]≥5 cm占33% )。初始进入安全性导入组的14例患者完成6周期以上I+V治疗(中位治疗时间: ibr 9.9 月,ven 7.2月)。在安全性导入期间,所有患者未出现剂量限制性毒性,并且均产生疗效反应(1/5例早期骨髓CR;13/14 PR);9/11例患者外周血MRD(-),97例患者(包括14例安全性导入组患者)完成ibr导入以及超过1剂量ven (I+V暴露组)治疗。发生率超过20%的不良反应事件(AEs)包括腹泻 (39%)、 乏力 (23%)、恶心 (23%)和关节痛(21%); 超过3%的3级以上AEs包括白细胞减少症(10%)、高血压(3%) 和血小板减少症 (3%)。无临床TLS发生,1例患者实验室检查结果提示TLS.在I+V暴露组基线LDi ≥5 cm的30例患者中,63%(19/30例) 患者在ibr导入治疗后LDi 缩小至<5 cm.77%(17/22例)的患者TLS风险由高危转为中低危。总体而言,在ibr导入治疗后,高风险TLS的比例由基线水平23%降低为3%。如有需要,请咨询海外医疗医学顾问:或扫码添加下方微信!
更多药品详情请访问 依鲁替尼
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话