欢迎光临吉康旅!
2021 年 10 月 13 日 / Bio / -- 默克公司最近宣布,美国食品和药物管理局 (FDA) 已批准联合铂类药物的抗 PD-1 疗法(®,通用名:)单克隆抗体)用于一线治疗的基于化疗(加或不加贝伐单抗 []),经 FDA 批准的检测方法证实表达 PD-L1(联合阳性评分 [CPS] ≥1) 患有持续性、复发性或转移性宫颈癌的患者。值得注意的是,这是首个获批用于这些患者一线治疗的抗PD-1联合疗法。来自关键的3-826期试验()数据显示,与化疗相比,一线治疗+化疗(±贝伐单抗)显着降低了 36% 的死亡风险。
宫颈癌仍然是 15-44 岁年轻女性癌症相关死亡的第二大原因,而女性在晚期诊断时的预后较差。在过去的 7 年中,没有任何一线疗法被批准用于治疗持续性、复发性或转移性宫颈癌。这是首个在铂类化疗(联合或不联合贝伐单抗[])一线治疗中提高持续性、复发性或转移性宫颈癌患者总体生存率的抗 PD-1/PD-L1 疗法。随着这一最新批准,铂类化疗(±贝伐单抗)将为这组患者带来新的一线治疗选择。
2018年6月,基于2-158期试验的肿瘤反应数据,FDA加速批准:作为单一疗法用于治疗既往化疗期间或之后的疾病进展,以及表达PD-L1(CPS≥1)的肿瘤)复发性或转移性宫颈癌患者。3期-826试验是加速批准宫颈癌治疗的确认性试验。基于-826试验的确认数据,FDA现已将此加速批准转变为常规批准。
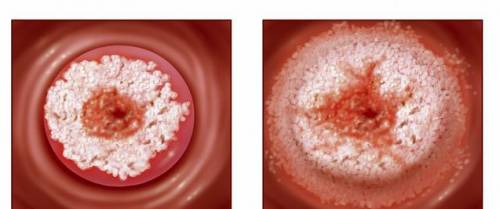
尽管在预防和筛查方面取得了进展,但宫颈癌仍然是一个经常影响年轻和中年女性的主要健康问题。被诊断患有转移性宫颈癌的女性预后特别差,迫切需要新的治疗方案。-826 是第一个在一线持续性、复发性或转移性宫颈癌中显示阳性免疫治疗结果的研究。
-826 试验在 617 名持续性、复发性或转移性宫颈癌(包括鳞状细胞癌、腺鳞癌、腺癌)患者中进行,与安慰剂相比,联合铂类化疗(紫杉醇 + 顺铂,或紫杉醇 + 卡铂)联合或不联合贝伐单抗() 为一线治疗。和安全。该研究的主要终点是总生存期(OS)和无进展生存期(PFS)。次要终点包括:总体反应率(ORR)、反应持续时间(DOR)和安全性。
结果显示,在表达PD-L1的肿瘤患者中(CPS≥1):+化疗(±贝伐单抗)相比安慰剂+化疗(±贝伐单抗)改善了OS、PFS、ORR、DOR。无论结果是否相同。或不添加贝伐单抗。
具体数据为:(1)OS,与安慰剂+化疗(±)相比,+化疗(±)降低了36%的死亡风险(HR=0.64[95%CI :0.50-0.81]; p=0.0001).(2)PFS方面:vs安慰剂+化疗(±贝伐单抗)+化疗(±) 将疾病进展或死亡的风险降低了 38% (HR=0.62 [95% CI, 0.50- 0.77];p
宫颈癌是全球女性癌症死亡的第四大原因,尽管宫颈癌可以出现在任何年龄的女性中,但最常见于 35-44 岁的女性。几乎所有病例都是由人乳头瘤病毒 (HPV) 感染引起的,大约 80% 被归类为鳞状细胞癌 (SCC,起源于宫颈基底部的细胞),其余大部分是腺癌 (起源于宫颈)。上腺细胞)。
尽管常规医学筛查和预防(HPV 疫苗)取得了进展,但宫颈癌仍然普遍存在。据估计,全球每年新增宫颈癌病例超过 60 万例,死亡病例超过 34 万例。宫颈癌在早期发现并得到有效治疗时通常可以治愈,但晚期、复发性或转移性宫颈癌的治疗选择有限且生存率低。在美国,被诊断患有已扩散到身体远处部位的宫颈癌的患者的 5 年生存率估计约为 17%。
它是一种 PD-(L)1 肿瘤免疫疗法,通过提高人体免疫系统的能力来帮助检测和对抗肿瘤细胞。是一种人源化单克隆抗体,可阻断 PD-1 与其配体 PD-L1 和 PD-L2 之间的相互作用,从而激活可能影响肿瘤细胞和健康细胞的 T 淋巴细胞。
截至目前,全球已批准10余种PD-(L)1肿瘤免疫疗法,在该领域处于领先地位。默克公司拥有业内最大的免疫肿瘤临床开发项目,目前有 1,600 多项临床试验正在针对多种肿瘤类型和治疗环境进行研究。该临床项目旨在了解该药物如何在癌症中发挥作用,以及可以预测患者从治疗中获益的因素,包括探索几种不同的生物标志物。(生物谷)
原始来源:FDA's ® () Plus , With or , as with , or PD-L1 (CPS ≥1)
免责声明: 本站关于疾病和药品的介绍仅供参考,实际治疗和用药方案请咨询专业医生和药师。

微信扫码◀
免费咨询电话